Первые года развития молекулярной биологии рака находились под давлением гипотезы Кнудсена двух ударов («two hit»): нормальная аллель определенного гена, у которого другая мутированная аллель передавалась по родительской линии, мутировала в течение жизни, теряя (loss-of-function) или усиливая функцию (gain-of-function). Протеиновый продукт этого гена, вовлеченного в клеточный цикл или сигналинг продукта которого важен для прохождения клеточного цикла), мог быть опухоль-супрессорным геном, онкогеном, либо геном стабильности. В результате пострадавшая клетка постоянно стремилась войти в клеточный цикл, а часть ее потомства в борьбе за нутриентные ресурсы или кислород выживало в конкурентных условиях неблагоприятной среды, таким образом проводя селекцию наиболее агрессивных клонов.
Онкогенная теория туморогенеза, полагающаяся на гипотезу Кнудсена, началась с идентификации в 1974 году первого вирусного онкопротеина SRC, который присутствовал в нормальном геноме. Десятилетие спустя за этим событием последовало открытие генов, чьи протеиновые продукты могут супрессировать рак: были идентифицированы ретинобластомный протеин (Rb1) и опухолевый протеин p53 (Trp53), которые промотировали туморогенез вследствие инактивирующих мутаций. Эти открытия подкрепляли мутационную теорию рака, и благодаря большому количеству секвенирований опухолевых клеток были зафиксированы мутационные сигнатуры для многих типов рака. Онкогенная теория вела к опухоль-центрическому взгляду на рак, при котором опухолевые клетки подвергаются эволюционной селекции для формирования более злокачественных и метастатических клеток.
Несмотря на доминирующее мнение о том, что одних только мутаций достаточно для возникновения рака, несколько новаторских экспериментов показали, что опухолевая микросреда (TME) может супрессировать раковый рост. Эти исследования начались с концепции семян и почвы, предложенной Paget, которая предполагала, что определенные микросреды поддерживают рост и распространение метастатических клеток. Окончательное исследование, показавшее важность микросред, показало, что растущие клетки злокачественной тератокарциномы в эмбриональной микросреде могут супрессировать злокачественный фенотип, и из раковых клеток развивались нормальные ткани эмбриона. Мощный трансформирующий вирус Rous sarcoma (ras) супрессировался при введении в нераковую среду эмбрионального крыла цыпленка. Но раны куриных крыльев активируют SRC онкоген и впоследствии формируют опухоли. Кроме того, в 2015 г. наблюдения мутаций, вызывающих рак, в нормальном эпителии, которые не прогрессируют в рак, предположили, что для прогрессирования опухоли они должны трансформировать свою микросреду (и, возможно, системную среду) в окружение, которое благоприятствует росту опухолевых клеток, то есть в проопухолевую.
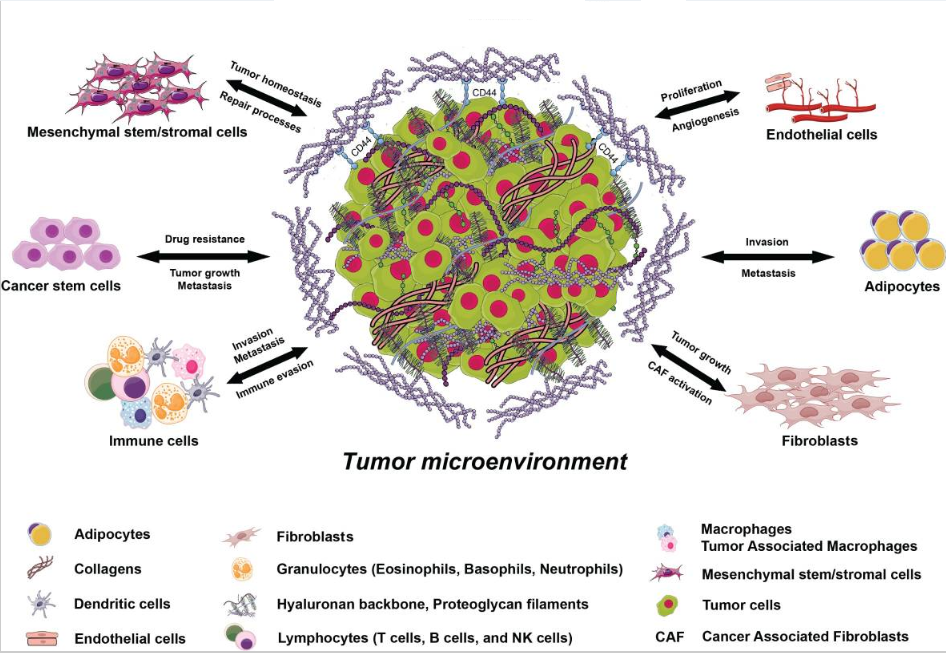
Опухолевая микросреда (tumor microenvironment, TME) определяется как среда, которая помимо раковых стволовых и раковых дифференцированных состоит из большого разнообразия клеток хозяина, включая иммунные клетки, фибробласты, мезенхимальные (стволовые) клетки, компонентов внеклеточного матрикса, кровеносных сосудов и формирующих их эндотелиальных клеток и перицитов, сигнальных молекул, таких как хемокины, цитокины и факторы роста, в которых раковые клетки пролиферируют и распространяются, что приводит к большим вариациям O2, CO2, pH и гидростатического давления, которые действуют как критические детерминанты клинического прогрессирования и ответа на терапию.
TME детерминирует рост, прогрессирование и экспансию рака. Она также косвенным образом свидетельствует, что таргетные препараты, действующие на мутантные сигнальные пути, мало или совсем неэффективны в распространенных опухолях.
В дальнейшем мы разберем каждый вопрос отдельно настолько, насколько нам позволят современные знания молекулярной онкологии. Пока вопросов больше, чем ответов на них.