Введение
Десять лет назад к списку характерных признаков рака — группе молекулярных свойств, характеризующих злокачественные опухоли — добавились опухоль-промотирующее воспаление и избегание иммунной деструкции. В них подчеркивается важность опухоль-ассоциированного воспаления и иммуносупрессии в понимании биологии рака, создании новых методов лечения и оптимизации существующих (Hanahan and Weinberg 2011).
В нормальных условиях злокачественные клетки определяются и уничтожаются иммунной системой процессом, называемым иммунным надзором. Однако этот защитный механизм иногда не срабатывает, и клетки, уклоняющиеся от иммунитета, подвергаются селекции (процесс иммунной редакции), и индуцируют определяемые раковые образования. Раковые клетки не только избегают детекции, но и оказывают иммуносупрессорный эффект, который перестраивает опухолевую микросреду (TME), начинает промотировать опухолевый рост, а не ингибировать его. Хотя воспаление по-прежнему наблюдается в опухолевом сайте, оно больше не служит своей цели (Ostrand-Rosenberg 2008). И клетки врожденной иммунной системы [макрофаги, нейтрофилы, дендритные клетки (DC), врожденные лимфоидные клетки (ILC), миелоид-дериватные супрессорные клетки и естественные киллерные (NK) клетки], и клетки адаптивного иммунитета (Т-клетки и В-клетки), присутствующие в опухолевом сайте, модулируют прогрессирование, инвазию и метастазирование опухоли путем секреции цитокинов и других механизмов (Hinshaw and Shevde, 2019). Многочисленные противоопухолевые терапии усиливают эти неблагоприятные изменения в TME, что может быть причиной снижения эффективности лечения с течением времени (Shaked 2019). Двойственный, про- и противоопухолевый характер иммунного ответа на рак делает его ценной мишенью для терапии, и понимание этого также может помочь повысить эффективность более традиционных методов лечения рака (Molinaro et al. 2018).
Элементы опухоль-ассоциированного воспаления
Роль генетических аберраций в раковых клетках
Для развития опухоли необходимы генетические аномалии. Помимо их роли в нарушении регуляции клеточных процессов, таких как клеточный цикл, апоптоз, миграция и выживание, они также коррелируют с иммунным ландшафтом опухоли (Wellenstein and Visser, 2018; Rooney et al., 2015). Интрисинговые генетические реакции в опухолевых клетках ведут к активации определенных транскрипционных факторов, включая NF-κB (nuclear factor-κB), STAT3 (signal transducer and activator of transcription 3) и HIF1α (hypoxia-inducible factor 1α). В результате из трансформированных клеток секретируются различные цитокины, хемокины, факторы роста, простагландины, активные формы кислорода и азота. Эти медиаторы способствуют задействованию лейкоцитов, которые также продуцируют множество медиаторов воспаления, инициируя дополнительные воспалительные сигналы в других опухолевых, стромальных и иммунных клетках. Усиленный канцер-ассоциированный воспалительный каскад способствует опухолевой пролиферации, ангиогенезу, инвазии, метастазированию и уклонению от иммунитета злокачественных клеток (Yang and Lin 2017; Mantovani et al. 2008; Cunha et al. 2019; Nakamura and Smyth 2017).
Например, потеря NF1 в глиомных клетках приводит к повышеннию присутствия макрофагов (Wang et al. 2017a). В ER-негативных базальноподобных опухолях молочной железы потеря гетерозиготности или мутация TP53 ассоциированы с более низкой лимфоцитарной инфильтрацией по сравнению с таковыми для р53 дикого типа (Quigley et al. 2015). Мутации в раковых клетках иногда приводят к экспрессии неоантигенов с последующим присутствием специфичных к неоантигенам Т-клеток, как это наблюдается у пациентов с меланомой (Linnemann et al. 2015). Генетические аберрации также могут влиять на NK-клеточный ответ, например, в опухолевых нейробластомых клеточных линиях, где гиперэкспрессия MYCN коррелирует с более низкой экспрессией лигандов для NKG2D (natural killer group 2, member D) и DNAM-1 (DNAX accessory molecule-1) NK клетка-активирующих рецепторов (Brandetti et al. 2017). Кроме того, влияние на состав опухолевой микросреды наблюдалось в опухолях щитовидной железы с мутациями BRAF или RAS (Charoentong et al. 2017), а также согласно данным The Cancer Genome Atlas в различных опухолях с мутациями в PIK3CA, MET, VHL или STK11 (Wellenstein and Visser 2018; Rooney et al. 2015). Изменения в рецепторных тирозинкиназах (RTK), как и во время активации RET трансфекции (rearranged during transfection) и повышения сигналинга рецептора эпидермального фактора роста (EGFR), а также Ras (oncogenic rat sarcoma virus protein), способствуют экспрессии провоспалительных цитокинов (Yang and Lin 2017). Аналогичные результаты наблюдались в опухолях с мутантными p53, APC и трансформирующим фактором роста бета (TGFβ), что подтверждает их роль в формировании иммунной опухолевой среды (Yang and Lin 2017; Agupitan et al. 2020). Это всего лишь несколько примеров влияния генетических аберраций на иммунный контекст опухолей. С терапевтической точки зрения важно оценить, существует ли прямая связь между генетическими раковыми абберациями и его иммунным ландшафтом, поскольку это позволяет создать новые персонализированные стратегии для пациентов (Wellenstein and Visser, 2018).
MDSC
Миелоид-дериватные супрессорные клетки (MDSC) представляют костный мозг-дериватные, высоко гетерогенные, незрелые клетки, которые в значительной степени способствуют иммуносупрессии в TME, нарушая и врожденные, и адаптивные иммунные ответы (Hinshaw and Shevde 2019; Emami Nejad et al. 2021; Vito et al. 2020; LaGory and Giaccia 2016; Ostrand-Rosenberg and Fenselau 2018). MDSC можно классифицировать на моноцитарные MDSC (M-MDSC), полиморфноядерные MDSC (PMN-MDSC) и MDSC ранней стадии (eMDSC). M-MDSC и PMN-MDSC, представленные в опухолевом сайте, демонстрируют более выраженные противовоспалительные свойства, чем MDSC вне TME. MDSC облегчают метастазирование, повышая ангиогенез и инициируя развитие предметастатической ниши (Hinshaw and Shevde 2019).
Они усиливают поляризацию макрофагов в сторону М2 фенотипа, привлекают регуляторные Т-лимфоциты (Treg), снижают цитотоксичность NK-клеток и супрессируют функцию Т-клеток, благоприятствуя опухолевому прогрессированию. Например, MDSC способствуют росту и метастазированию рака молочной железы, вызывая истощение Т-клеток (Zhu et al. 2017a). Множество перекрывающихся путей управляет инфильтрацией MDSC опухолевого сайта (Ostrand-Rosenberg and Fenselau 2018). Например, CXCL5 (C-X-C motif chemokine ligand 5) является опухоль-секретируемым хемокином, который привлекает MDSC, экспрессирующие (C-X-C motif chemokine receptor 2), и, как следствие, его супрессия прерывает развитие опухоли (Wang et al. 2016). В гепатоцеллюлярной карциноме эти миелоид-дериватные клетки могут аккумулироваться в гипоксической TME через CCL26 (C–C motif chemokine ligand 26) (Chiu et al., 2016) или через эктонуклеозидтрифосфатдифосфогидролазу 2 (ENTPD2) (Chiu et al. 2017). В почечно-клеточной карциноме присутствие PMN-MDSC коррелирует с секрецией интерлейкина-1β (IL-1β), IL-8, CXCL-5 и макрофагального воспалительного протеина-1α (Mip-1α) (Najjar et al. 2017). Примечательно, что MDSC снижают эффективность многочисленных терапевтических стратегий, таких как терапия ингибиторами иммунных чекпоинтов, и, следовательно, ряд текущих исследований сосредоточен на их устранении из TME (Ostrand-Rosenberg and Fenselau 2018).
Опухоль-ассоциированные макрофаги
Макрофаги — иммунные клетки, присутствующие в различных тканях, где они детектируют признаки патогенов или повреждений. Если последние обнаружены, они стимулируют реакцию лимфоцитов и других иммунных клеток (Murray and Wynn, 2011). Их можно разделить на две популяции; M1, которые индуцируются хелперными цитокинами 1T типа (Th1) или распознаванием бактериальных липополисахаридов и проявляют провоспалительную активность, и M2, также называемые альтернативно активированными макрофагами, индуцируемые хелперными цитокинами 2T типа (Th2), демонстрирующие противовоспалительные, проангиогенные и профибротические черты (Shapouri-Moghaddam et al. 2018). Макрофаги являются одним из наиболее распространенных типов клеток в TME и, по оценкам, составляют до 50% массы раковой ткани (Zhang et al. 2019).
Макрофаги, представленные в опухоли, в определенных условиях перестраиваются в опухоль-ассоциированные макрофаги (ТАМ). Цитокины IL-4 и IL-13 являются сильными индукторами альтернативной (М2) активации макрофагов. Кроме того, гиперэкспрессия IL-34 в остеосаркоме за счет задействования М2-подобных макрофагов ассоциирована с повышенным опухолевым ростом, васкуляризацией и метастазированием (Szebeni et al. 2017). ТАМ обладают активностью и характеристиками, сходными с М2 макрофагами; тем не менее, они также разделяют M1 сигнатурную поляризацию (Chavez-Galan et al. 2015). Сигналы в опухолевой среде [IL-4, IL-6, IL-10, простагландин E2 (PGE2), колониестимулирующий фактор 1 (CSF-1) и TGF-β] поляризуют макрофаги в альтернативные, провоспалительные, проангиогенные и иммуносупрессорные, протуморальные М2-подобные клетки (Caronni et al. 2015).
Повышенный уровень лактата в TME также стимулирует дифференцировку макрофагов в сторону M2 фенотипа, активируя ERK/STAT3 (extracellular signal-regulated kinase/signal transducer and activator of transcription 3) сигнальный путь. Ингибирование ERK/STAT3 может вызвать замедление пролиферации и миграции раковых клеток молочной железы, индуцированные лактат-активированными макрофагами (Mu et al. 2018). В гепатоцеллюлярной карциноме (HCC) ТАМ облегчают экспансию раковых клеток благодаря секреции IL-6, активирующего STAT3. ТАМ также индуцируют эпителиально-мезенхимальный транзит и промотируют клеточную миграцию через JAK2/STAT3 (janus kinase 2/signal transducer and activator of transcription 3) сигнальный путь. STAT3 можно рассматривать как таргетную молекулу (Chavez-Galan et al. 2015). ТАМ оказывают проангиогенное, проинвазивное и иммуносупрессорное действие на опухоль и, следовательно, могут рассматриваться как многообещающий объект в иммунотерапии опухолей (Zhou et al., 2020a).
ТАМ возникают из двух разных клеточных популяций. Предположительно, ткань-резидентные макрофаги первоначально должны трансформироваться опухолевыми клетками с приобретением проопухолевого M2-подобного фенотипа. В дополнение к этому моноциты периферической крови задействовуются в TME и поляризуются в M2-подобные ТАМ (Zhou et al. 2020b). Это происходит в ответ на хемокины и факторы роста, продуцируемые стромальными и опухолевыми клетками в TME. К ним относятся CCL2, CSF1, фактор роста сосудистого эндотелия A (VEGF-A), CCL18, CCL20 и CXCL12 (Yang and Zhang 2017). Кроме того, гиперэкспрессия адгезивной молекулы сосудистых клеток-1 (VCAM-1) ассоциирована с более высокой инфильтрацией макрофагами (Zhang et al. 2019). ТАМ происходят из циркулирующих моноцитов Ly6C+ CCR2+ или из ткань-резидентных макрофагов, которые являются дериватами CXC3CR1+ Kit+ эритромиелоидных прогениторов желточного мешка или мышиной эмбриональной печени (мышиная модель) независимо от костного мозга (Wu and Zhang 2020). CCL2 был первоначально открыт как опухоль-дериватный хемоаттрактант, который задействует моноциты/макрофаги в опухолевую ткань (Szebeni et al. 2017). Таргетинг CCR2-CCL2 оси, которая является главной хемокиновой осью, ответственной за задействование моноцитов, представляет одну из стратегий, ассоциированных с ТАМ, которые в настоящее время проходят клиническое исследование (Wu and Zhang 2020). Анти-CCL2 антитело Карлумаб (Carlumab) ингибирует рост глиомы, рака толстого кишечника, предстательной железы и меланомы нва животных моделях. Однако дальнейшие клинические исследования показали, что Карлумаб не блокирует CCL-2/CCR-2 (C–C chemokine receptor 2) ось и не показывает противоопухолевой активности в метастатическом кастрация-резистентном раке предстательной железы. Необходимы дальнейшие клинические исследования для определения, можно ли добиться успеха Карлумаба в животных моделях и у онкологических пациентов. Успешное ингибирование CCL-2 может достигаться за счет блокирования IL-6. Анти-IL-6 антитело Силтуксимаб (Siltuximab) обладает противоопухолевым действием и снижает не только CCL-2, но также экспрессию VEGF и CXCL-12 (Sawa-Wejksza and Kandefer-Szerszen 2018) (см. Фиг. 1).
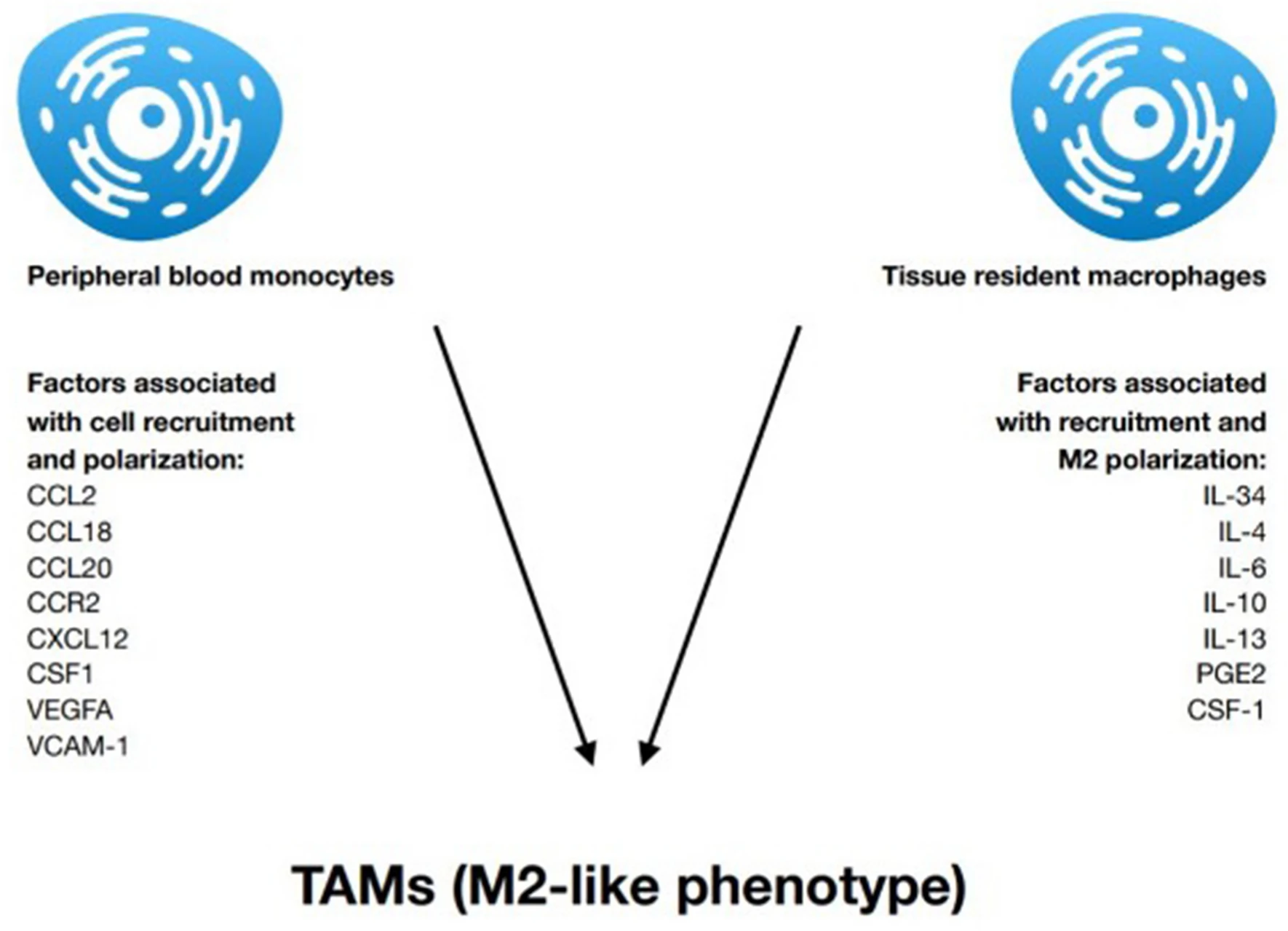
Фиг. 1. Наиболее важные цитокины, ассоциированные с задействованием периферических и резидентных макрофагов в опухолевый сайт и их поляризацией в М2-подобный фенотип
Нейтрофилы
Подобно макрофагам, опухоль-ассоциированные нейтрофилы (TAN) также можно классифировать как иммуностимулирующие N1 нейтрофилы и иммуносупрессорные N2 нейтрофилы. Одним из механизмов привлечения нейтрофилов в TME является секреция CXCL1, CXCL2, CXCL5 и CXCL8 злокачественными клетками и опухолевой стромой. Следует отметить, что высокая инфильтрация этих воспалительных клеток коррелирует с неблагоприятным прогнозом для пациентов со многими типами рака. Нейтрофилы усиливают опухолевой рост, ангиогенез и метастатический потенциал. Например, они продуцируют CCL17 для задействования Treg, которые сайленсируют иммунный ответ (Liang and Ferrara 2016). TGF-β способствует поляризации нейтрофилов в N2 фенотип, характеризующийся опухоль-стимулирующими свойствами (Emami Nejad et al. 2021; LaGory and Giaccia 2016; Liang and Ferrara 2016). Они секретируют цитокины, хемокины, активные формы кислорода, активные формы азота, оксид азота и матриксные металлопротеиназы для стимулирования ангиогенеза, метастазирования и инвазии рака (Hinshaw and Shevde 2019; Cunha et al. 2019). Интересно, что злокачественные клетки усиливают выброс ядерной или митохондриальной ДНК нейтрофилами, известный как формирование нейтрофильных внеклеточных ловушек (NET), потенциально способствуя прогрессированию метастатического рака (Tohme et al. 2016; Park et al. 2016).
Лимфоциты
Опухоль-инфильтрирующие лимфоциты (TIL) являются одним из важнейших элементов опухолевой структуры. Цитотоксические Т-клетки (CTL) способны распознавать опухоль-ассоциированные антигены и уничтожать опухолевые клетки либо с помощью секретируемых молекул (перфорины и гранзимы), либо с помощью смертельных лигандов (Martínez-Lostao et al. 2015). Высокая инфильтрация лимфоцитов коррелирует с положительным исходом в различных онкологических заболеваниях (Ferrari et al. 2019). Опухоли продуцируют широкий спектр цитокинов и хемокинов, которые индуцируют миграцию иммунных клеток в TME, но они также могут гипорегулировать некоторые сигнальные пути для редукции химиоаттракции воспалительных клеток, таких как CTL.
Раковые клетки также используют несколько инструментов для собственной защиты от уничтожения (Woude et al. 2017). Экспрессия PD-L1 (programmed cell death ligand 1) и CTLA-4 (cytotoxic T-lymphocyte-associated protein 4), которые вызывают истощение Т-клеток, по-видимому, является наиболее примечательной тактикой (Woude et al. 2017; Tu et al. 2020). Терапевтический подход, таргетирующий эти протеины, известный как терапия ингибиторами иммунных чекпоинтов (ICI), обсуждается в другом разделе этой статьи. Другая стратегия уклонения от иммунитета зависит от секреции индоламин-2,3-диоксигеназы (IDO), которая вызывает дефицит триптофана и продукцию кинуреина, приводя к апоптозу Т-клеток. Кроме того, ранее упомянутый в контексте N2 нейтрофилов, TGF-β, продуцируемый раковыми клетками, и другие компоненты TME ингибируют пролиферацию и активацию Т-клеток, сайленсируя их противоопухолевую активность (Woude et al. 2017). Гипоксия в опухолевом сайте супрессирует противоопухолевую активность TIL (Emami Nejad et al. 2021; Woude et al. 2017). В целом, злокачественные клетки могут эффективно нарушать свойства CTL, и в клинических исследованиях используется множество стратегий, разрушающих эти неблагоприятные перекрестные взаимодействия (Woude et al. 2017).
В отличие от CTL, Treg представляют иммуносупрессорные субпопуляции Т-клеток, ассоциированные с неблагоприятным исходом у онкологических больных, за исключением колоректального рака. Они характеризуются экспрессией Foxp3 (forkhead box P3) и CD25 (cluster of differentiation 25) и играют решающую роль в профилактике аутоиммунитета (Moreno Ayala et al. 2019; Ohue and Nishikawa 2019). В контексте опухоли Treg ингибируют воспалительный ответ несколькими путями. Они блокируют костимулирующие сигналы от DC, элиминируют CTL через ICI и убивают антиген-презентирующие клетки, используя секретируемые молекулы и смертельные лиганды. Они также экспрессируют иммуносупрессорные цитокины, расходуют IL-2 и модулируют метаболические взаимодействия в опухолевом сайте, снижая уровень аденозинтрифосфата (АТФ) и индуцируя экспрессию IDO в DC (Ohue and Nishikawa 2019). Эти высокие опухоль-промотирующее свойства делают Treg серьезной проблемой для противоопухолевой иммунотерапии. Текущие исследования сосредоточены на селективном таргетинге Treg для индукции дополнительного противоопухолевого иммунитета без тяжелых аутоиммунных реакций (Moreno Ayala et al., 2019; Tanaka and Sakaguchi, 2019).
Продолжение следует