Введение
Злокачественные опухоли характеризуются быстрым ростом, плохим прогнозом и высокой смертностью; кроме того, ранняя диагностика таких опухолей достаточно сложна, а эффективные методы лечения отсутствуют [1]. Опухолевые клетки показывают непрерывное деление и пролиферацию, потребляя большое количество кислорода и нутриентов. При объеме солидной опухоли менее 2 мм3 кислород и питательные вещества могут быть получены путем диффузии. Однако при превышении этого объема центр солидной опухоли не может получать достаточное количество кислорода и питательных веществ только за счет диффузии, и клетки в этой области подвергаются голоданию и пребывают в гипоксической микросреде [2, 3]. Чтобы соответствовать требованиям непрерывного размножения, опухолевые клетки проходят адаптацию под влиянием агрессивной среды, что приводит к прогрессированию в более злокачественное состояние. При постепенном росте опухолевой ткани опухоль нуждается в формировании новых кровеносных сосудов для получения питательных веществ и кислорода [4].
В клиническую практику введено множество таргетных препаратов, но их действие не очень эффективно. Это может быть следствием активации других ангиогенез-ассоциированных процессов [6]. Васкулогенная мимикрия (VM) — недавно открытый метод ангиогенеза, обнаруженный во многих злокачественных опухолях, который обеспечивает новую стратегию клинического лечения опухолевого ангиогенеза. Сосуды, формируемые в VM, состоят из эндотелиальных опухолевых клеток, поддерживаемых периодической кислотой-Шиффом (PAS)-позитивными клетками, и обогащены компонентами внешнего матрикса. Эти трубки транспортируют нутриенты и эритроциты, несущие кислород к опухоли [7]. Механизм, лежащий в основе возникновения VM, до конца не выяснен. Начальная гипоксическая среда в солидных опухолях неотделима от VM.
В гипоксической опухолевой микросреде некоторые пластические опухолевые клетки, такие как раковые стволовые клетки (РСК), демонстрируют повышенную стволовость и активированный потенциал дифференцирования. Гипоксия также индуцирует эпителиально-эндотелиальный переход (ЭЭТ) РСК. Во время этого процесса CSC теряют некоторые эпителиальные маркеры и приобретают свойства эндотелиальных клеток. Поскольку ключевые молекулы в EET почти такие же, как и в эпителиально-мезенхимальном транзите (EMT), эти два процесса часто путали в предыдущих исследованиях. EET также был описан как подтип EMT [8]. Учитывая, что этот переход необходим для процесса ВМ, считаем более правильным назвать его ЭЭТ; соответственно, этот термин используется в следующем тексте, чтобы подчеркнуть его различия. В данном обзоре сначала вводится определение ВМ в гипоксической микросреде и ее ключевые звенья, а затем основное внимание уделяется молекулярным механизмам с участием РСК, ЭЭТ и перестройки внеклеточного матрикса в развитии ВМ в гипоксической опухолевой микросреде.
Ключевые процессы сосудистой мимикрии
Гипоксия, несомненно, является наиболее типичным признаком опухолевой микросреды; это также важнейший фактор, индуцирующий злокачественную трансформацию опухолевых клеток [9]. Гипоксия вызывает в опухоли ряд изменений, включая метаболические изменения, иммунная эвазия, ангиогенез и т.д. Этот процесс сопровождается активацией большого числа клеточных путей; из них гипоксия-индуцибельный (HIF) является наиболее критической молекулой, регулирующей экспрессию большинства гипоксия-ассоциированных генов. В гипоксической микросреде опухолевые клетки формируют новые кровеносные сосуды для получения необходимого кислорода и питательных веществ, поддерживающих их дальнейшую пролиферацию. Ягипоксия тесно ассоциирована с развитием VM. Гипоксия или HIF молекулы стимулируют процесс VM при множественных типах опухолей. HIF-1 также может напрямую прямо регулировать экспрессию множества молекул, ассоциированных с VM, таких как VEGF, Twist, LOX, MMP2 и MIFect [17].
В 1999 г. Maniotis et al. первыми описали трубчатую структуру, состоящую из клеток меланомы, дифференцировавшихся в клетки с эндотелиальными характеристиками в злокачественной меланоме. Рядом с этими протоками васкулярная эндотелиальная клетка не найдена. Однако показано, что эти протоки содержат эритроциты и другие вещества, позволяя предположить, что их роль аналагична традиционным кровеносным сосудам. Поэтому формирование таких структур назвали [7]. VM феномен найден во многих типах рака и тесно ассоциирован с высокой агрессивностью опухоли и неблагоприятным прогнозом для пациентов [18, 19].
Опухолевые клетки, демонстрирующие VM, также обладают высоко агрессивными и метастатическими характеристиками, включая маркеры опухолевых клеток, маркеры эндотелиальных клеток, маркеры пластичности/стволовости и т. д. [20]. VM структуры описываются как структуры с высоко перфузионные, матрикс-обогащенные трубчатые, паттерн-подобные матриксные структуры, содержащие коллаген, гепарансульфатные протеогликаны и плазму. В отличие от традиционного ангиогенеза, васкулярные эндотелиальные клетки и фибробласты не показывают VM, для которого характерно плотное отложение опухолевых клеток и внеклеточного матрикса. Гликопротеины, образующие эти структуры, включают коллаген I, IV и VI типов, ламинин Ln5 и продукты его расщепления γ2x и γ2´ [7, 21]. Присутствие CD31/CD34-негативных и PAS-позитивных клеток, а также эритроцитов в протоке обычно используется в качестве критерия идентификации ВМ [22, 23].
Некоторые исследования недавно показали, что метод маркировки CD31-/PAS+ не является точным и необходимо найти более подходящий метод [24]. В глиобластоме было обнаружено расположение CD34-негативных клеток в сосудистой трубке, содержащей эритроциты, и эти клетки были опухолевыми. Впоследствии выполняли серийные срезы ткани и окрашивание для определения характера протока. Обнаружена область соединения CD34-негативных и позитивных клеток, что указывает на то, что структура протока была непрерывной с нормальными кровеносными сосудами [25].
Клетки, подвергшиеся ВМ, прямо экспонируются кровотоук, а шединговые клетки легко переносятся с кровью. Таким образом, ВМ обычно возникает при высокоинвазивных, сильнометастатических и распространенных злокачественных опухолях, что часто указывает на плохой прогноз для пациента [26]. Хотя специфический механизм, лежащий в основе индукции ВМ, полностью не выяснен, вероятно, что процесс включает трансформацию опухолевых паренхиматозных клеток и изменение компонентов внеклеточного матрикса опухоли. К специфическим механизмам относятся CSC, EET и перестройка ECM (Фиг. 1).
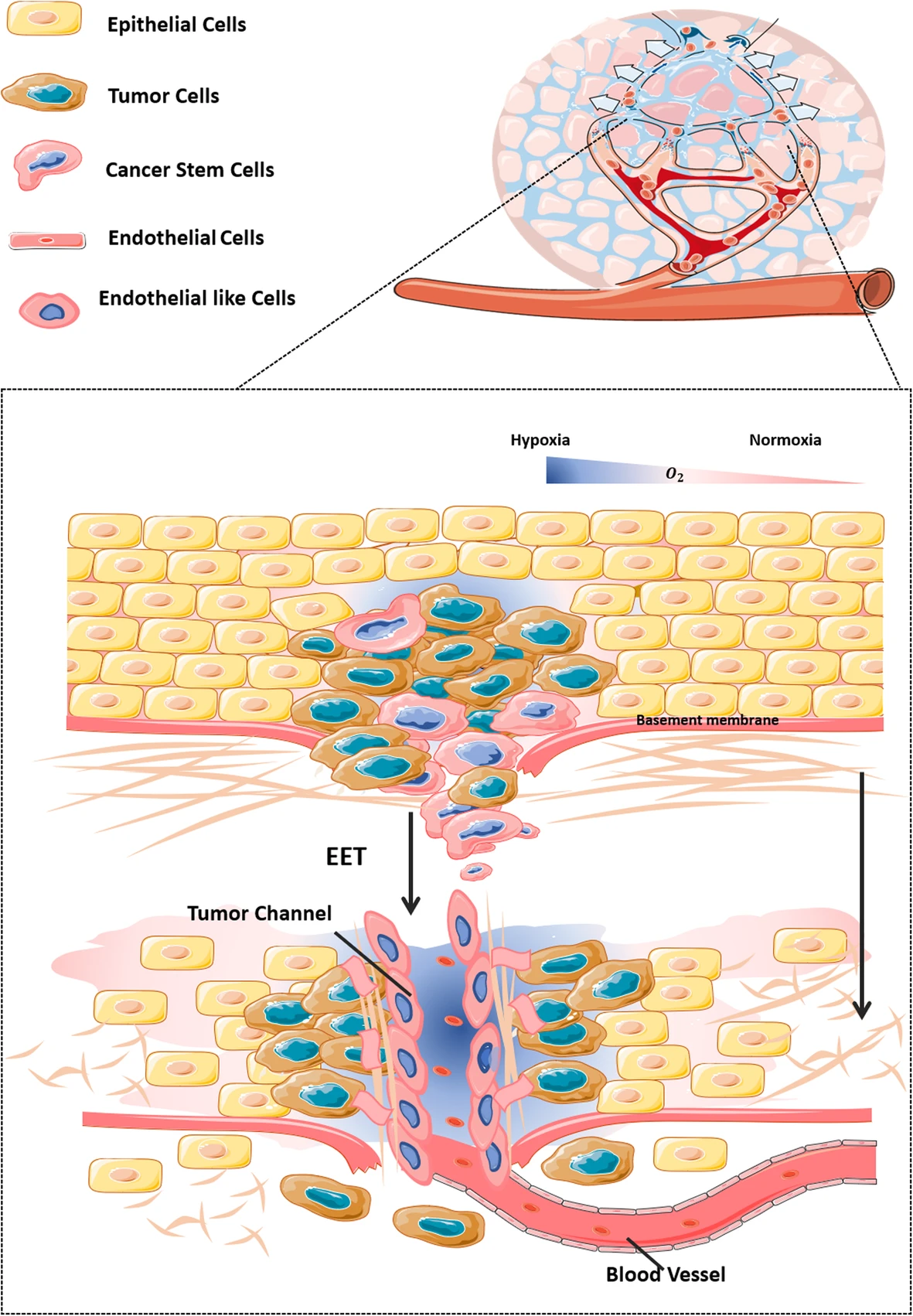
Фиг. 1. Ключевые процессы, вовлеченные в васкулогенную мимикрию в гипоксических условиях
HIF повышает the stemness and дифференцирование потенциальные of cells with strong plasticity in the highly malignant tumor cell population (especially tumor stem cells) in the опухолевая микросреда; these tumor cells then transform to more mobile cells through the EET process induced by hypoxia.
HIF повышает стволовость и потенциал дифференцирования клеток с высокой пластичностью в высокозлокачественной клеточной популяции (особенно опухолевых стволовых клеток) в опухолевой микросреде; эти опухолевые клетки затем трансформируются в более подвижные клетки посредством процесса EET, вызванного гипоксией.
По мере растяжения и удлинении клеток, экспрессия ассоциированных транскрипционных факторов, Twist и Snail в клетке становится гиперактивной, вызывая гипорегуляция протеина плотных контактов, Е-кадгерина, между эпителиальными клетками, наряду с гиперрегуляцией молекул, ассоциированных с ангиогенезом, таких как VE-кадгерин и фибронектин. Затем эти раковые стволовые клетки демонстрируют характеристики эндотелиальных клеток [27]. Через серию внутриклеточных сигнальных путей высокозлокачественные опухолевые клетки экспрессируют высокие уровни матриксной металлопротеиназы и других веществ, разрушая некоторые вещества, такие как ламинин, и перестраивая ECM, что способствует миграции опухолевых клеток и их трансформации в злокачественный фенотип, обеспечивая растяжение и почву для формирования VM сети [9, 28]. Эти гиперрегулированные протеины затем перестраивают опухолевые клетки через протокоподобные адгезии с формированием протокоподобные структуры одновременно с перестроенный внеклеточным матриксом; наконец, эти протоки инфильтрируют и расширяют в сосудистую сеть и начинают транспортировать эритроциты и нутриенты к опухолевым клеткам.
Гипоксия промотирует дифференцировку раковых стволовых клеток в эндотелий-подобный фенотип
Американское онкологическое общество определяет раковая стволовая клетка-подобные клетки (CSC), как тип опухолевых клеток, обладающий способностью к самообновлению и множественным потенциалом дифференцировки [29]; из них образуется лишь небольшая часть опухолевых клеток. Дифференцированные опухолевые клетки могут приобретать стволовость и становиться опухолевыми стволовыми клетками процессом, включающим множество механизмов, в том чмсле обязательное влияние гипоксии на CSC [30]. CSC также могут дифференцироваться в различные клетки. Например, глиобластома стволовая клетка-подобные клетки (GSC), культивируемые in vitro, могут продуцировать клетки с эндотелиальным фенотипом и функциональными характеристиками в условиях, способствующих дифференцировке эндотелиальных клеток [32, 33].
CSC прямо участвуют в развитии VM в некоторых типах рака [34] [35]. Однако механизм, с помощью которого CSC дифференцируются в направлении, сходном с эндотелиальными клетками, неясен. Микросреда значительно влияет на потенциальные возможности CSC дифференцироваться в разные фенотипы клеток. Это взаимодействие оказывает незаменимое влияние на развитие VM. CSC расположены в небольшой и специальной опухолевой нише, называемой нишей CSC. Эта ниша преимущественно содержит клеточные и неклеточные компоненты, сходные с опухолевой микросредой, включая фибробласты (CAF), эндотелиальные клетки (EC), иммунные клетки, мезенхимальные стволовые клетки (MSC), опухоль-ассоциированные макрофаги (TAM) и ECM [41].
Гипоксия также является важным регуляторным фактором в CSC нише; гипоксия способствует трансформации CSC в эндотелиальная клетка-подобные структуры. Гипоксическая микросреда играет важную роль в регуляции фенотипа и функции CSC в разных типах рака [42],[43], [44] [45]. Она может опосредованно или прямо действовать на ассоциированные транскрипционные факторы, такие как c-Myc, Sox-2 и Oct-4, путем индукции маркеров CSC, через аденозина/STAT3/IL-6 путь, MAPK/ERK путь, Notch, Wnt, Hedgehog, Hippo сигнальный путь и т. д. для промотирования мультинаправленного потенциала дифференцирования CSC [46] (Фиг. 2).
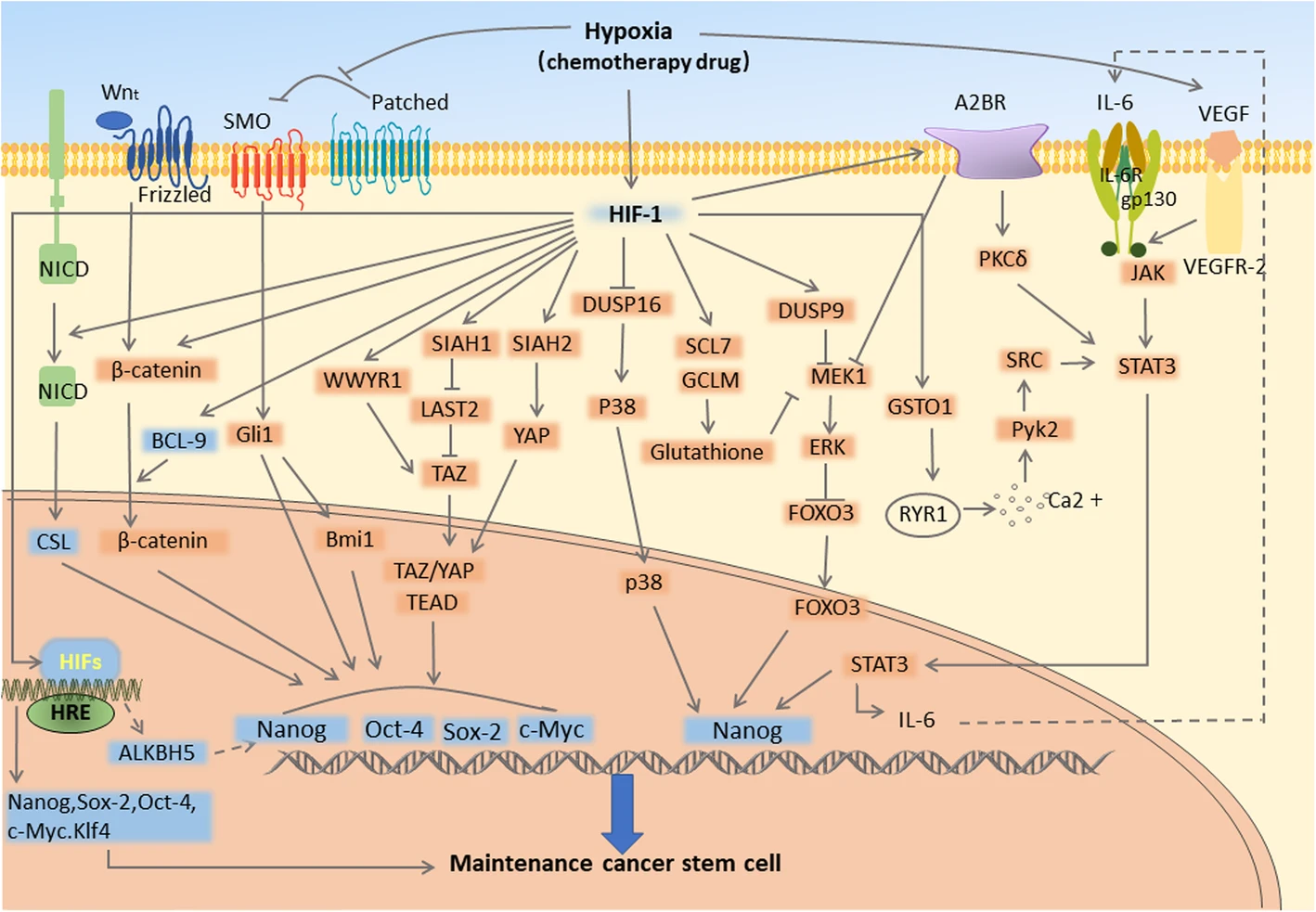
Фиг. 2. Основные пути, которыми гипоксия промотирует стволовость и дифференцирование CSC