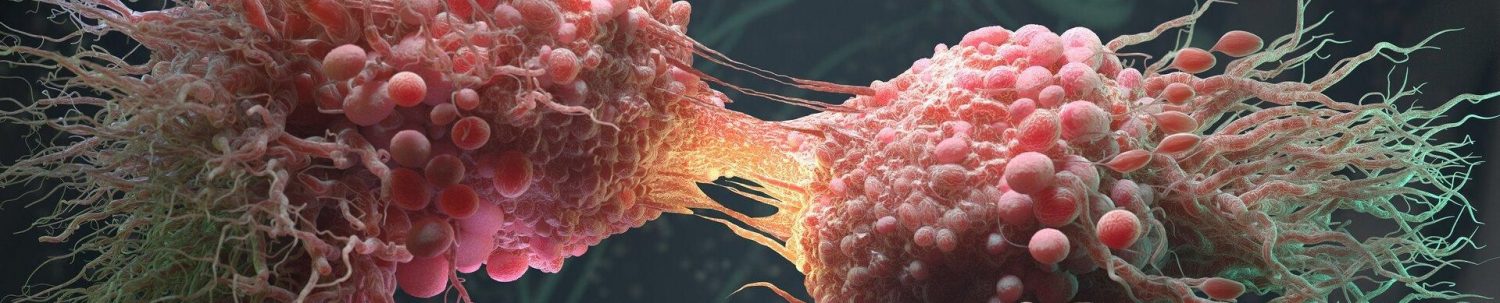
Опухоль-ассоциированные макрофаги могут быть поляризованы на провоспалительные (М1-подобные) и противовоспалительные (М2-подобные) фенотипы
Опухоль-ассоциированные макрофаги
TME является результатом сложных взаимодействий между различными типами клеток, включая опухолевые клетки, иммунные клетки, эндотелиальные клетки и фибробласты. ТАМ, составляющие 50–80% неопухолевых стромальных клеток, являются критическими компонентами TME. После задействования циркулирующих моноцитов через CCL2 (chemokine ligand 2)-CCR2 (chemokine-receptor 2) ось и многие другие хемокины и цитокины, такие как M-CSF (макрофагальный колониестимулирующий фактор), CX3CL1 (chemokine (C-X3-C motif) ligand 1), CCL3, CCL5 и фактора роста эндотелия сосудов A (VEGF-A) (1), TME будет благоприятствать их поляризации либо в сторону противовоспалительных, либо провоспалительных макрофагов, то есть M1-подобные или М2-подобные ТАМ, соответственно. Два основных статуса поляризации макрофагов составляют большую часть компартмента ТАМ с большим преобладанием М2-подобного фенотипа.
Однако эта дихотомия ТАМ является упрощенным способом представления их сложных функций в микросреда.. Тем не менее, существует согласие, что ТАМ преимущественно поляризованы на два основных подтипа, М1-подобные и М2-подобные ТАМ. Действительно, TAM будет меняться от одного типа к другому в зависимости от среды, в которой они находятся.
Кроме того, превалирование ТАМ во многих солидных опухолях связана с неблагоприятным прогнозом, опухолевым прогрессированием и метастазированием (5–7). Действительно, ТАМ способствуют развитию опухоли несколькими способами:
- Противовоспалительные ТАМ контролируют иммунный ответ, секретируя иммуносупрессивные цитокины и ферменты, что способствует росту и выживанию опухоли (8). ТАМ также нарушают способность опухоль-инфильтрирующих лимфоцитов (TIL) мигрировать и взаимодействовать со злокачественными клетками (9).
- ТАМ также повышают раковая стволовая клетка-подобные свойства опухолевых клеток (10), которые промотируют инвазивную способности и метастазированию рака на более поздних стадиях, включая формирование предметастатической ниши во вторичном очаге, экстравазацию и раннюю колонизацию (11, 12), и также способствуют ангиогенезу секрецией проангиогенных факторов, включая плацентарный фактор роста (PIGF), TGF-β, CCL2 и CXCL12 (13–15).
- Кроме того, ТАМ способствует канцерной резистентности и рецидивам после лечения лучевой терапией и некоторыми химиотерапевтическими агентами за счет высвобождения провыживательных факторов, что приводит к активации злокачественными клетками антиапоптотических сигнальных путей (16–18). Кроме того, прямой контакт миеломных клеток с макрофагами также может вызывать химиорезистентность (19). Действительно, рецидив противоопухолевого лечения может быть связан с полиморфизмом ТАМ в течение развития опухоли (20), например, при раке молочной железы, леченном таксолом (21), или гепатоцеллюлярной карциноме, леченной сорафенибом (22), как in vitro, так и in vivo (модель на мышах).
Таргетинг ТАМ может быть эффективной и многообещающей терапевтической стратегией для усиления противоопухолевого иммунитета. Современное создание потенциально, но еще не эффективных лекарственных средств, таргетирующих ТАМ, основана на истощении ТАМ, повышении фагоцитоза ТАМ, ингибировании активности моноцитов и перепрограммировании противовоспалительных М2-подобных ТАМ в провоспалительные М1-подобные ТАМ.
Провоспалительные макрофаги (М1-подобные)
IFN-γ был первым фактором, активирующим макрофаги, открытым в 1970 г. (23). IFN-γ является растворимым цитокином, продуцируемым активированными CD4+ T-хелперами (Th) 1-клетками, CD8+ T-цитотоксическими клетками и NK-клетками, который направляет макрофаги в статусе покоя в активные клетки с повышенным антигенпрезентирующим потенциалом, повышенным синтезом провоспалительных цитокинов и токсических медиаторов, и повышенным комплемент-опосредованным фагоцитозом среди прочих функций. Это раннее описание активации макрофагов стало известно как классическая активация. Поскольку классически активированные макрофаги являются результатом Th1 (цитотоксических) Т-клеточных ответов, эти макрофаги были переименованы в макрофаги M1. Помимо IFN-γ, макрофаги M1 могут дифференцироваться другими Th1 цитокинами, например, TNF-α, и бактериальными компонентами, например, липополисахаридом (LPS).
Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) также активирует М1 ответы и противоопухолевую активность (17). M1 макрофаги стимулируют ответ Th1 и цитотоксических клеток, которые, в свою очередь, высвобождают IFN-γ, тем самым усиливая поляризацию M1 в петле обратной связи (23–26). M1 макрофаги секретируют значительное количество провоспалительных цитокинов, включая IL-1β, IL-6, IL-12, IL-23, IFN-β и TNF-α, которые одновременно поддерживают Th1 ответы (27, 28). M1 макрофаги также являются основным источником IL-12, при этом они продуцируют мало или не продуцируют IL-10, что еще больше усиливает M1 поляризацию. Хемокины, продуцируемые М1 макрофагами, в основном относятся к СС типу (CCL2, CCL3, CCL4, CCL5, CCL8, CCL19, CCL20), кроме того, IFN-γ также увеличивает продукцию CXCL10 и CXCL9, ведя к экспрессии IFN-β. В целом эти хемокины способствуют установлению иммунного ответа 1 типа (29), результируя в защиту от внутриклеточных патогенов и опухолевого прогрессирования.
Провоспалительные макрофаги M1 могут действовать как супрессоры опухолей несколькими способами:
- Уничтожение злокачественных клеток. Провоспалительные макрофаги продуцируют активные формы кислорода (ROS) и повышают их продукцию опухолевыми клетками за счет секреции стимулов, подобных TNF-α. Макрофаги быстро генерируют супероксид преимущественно за счет NAPDH-оксидазы, результируя в синтез перекиси водорода (30). Кроме того, в течение воспаления оксид азота (NO), синтезируемый индуцибельной синтазой оксида азота (iNOS) из L-аргинина, реагирует с супероксидом с образованием радикалов пероксинитрита, которые по своей активности аналогичны гидроксильным радикалам и способствуют прямому апоптозу опухолевых клеток (31, 32). M1 также играют важную роль в опухолевой супрессии за счет генерации цитотоксических молекул, таких как TRAIL (TNF-α-related apoptosis inducing ligand) и FASL (FAS лиганд), либо путем антитело-зависимого клеточного фагоцитоза (Antibody-Dependent Cellular Phagocytosis, ADCP) или антитело-зависимой клеточно-опосредованной цитотоксичности (Antibody-Dependent Cell-mediated Cytotoxicity, ADCC) (24, 25).
- Стимуляция противоопухолевого иммунитета. Взаимодействие между NK-клетками и макрофагами представляет собой линию защиты от опухолей. M1 макрофаги экспрессируют CD48, который связывается с 2B4 рецептором на плазматической мембране NK-клеток, индуцируя IFN-γ, что, в свою очередь, поддерживает M1 фенотип. Кроме того, высвобождение IL-1β, IFN-β и/или IL-23 M1 макрофагами будет стимулировать экспрессию NKp44 (natural killer cell p44-related protein) и NKG2D (natural killer group 2 member D). Следовательно, NK-клетки будут нести цитотоксический ответ против таргетных клеток, экспрессирующих их лиганды, такие как стресс-лиганды (33, 34). Эти клетки также способны активировать CD8+ цитотоксические Т-клетки (35), которые являются наиболее мощными противоопухолевыми иммунными эффекторами и составляют основу современной эффективной иммунотерапии рака (36) за счет секреции ранее перечисленных хемокинов (CCL2, CCL3, CCL4, CCL5 и CXCL10) (37). Макрофаги M1 также экспрессируют молекулы главного комплекса гистосовместимости (MHC)-II и костимулирующие молекулы CD80/CD86, которые необходимы для Т-клеточной активации, продукции цитокинов, пролиферации и дифференцирования (38–41). M1 секретируемые CCL2, CCL5 или IFN-β могут повышать инфильтрацию нейтрофилами опухоли и способствовать провоспалительной нейтрофил-таргетной регрессии опухоли (42, 43).
Наиболее высокое соотношение M1/M2 обеспечивает самую длительную выживаемость у больных раком. Более низкая доля М2-подобных ТАМ в TME улучшает прогноз у пациентов с различными онкологическими показаниями. M1-подобные ТАМ также коррелируют с большей эффективностью используемой в настоящее время химиотерапии при раке яичников и легких (50, 51). M1-подобное обилие также связано с иммунологическим статусом опухоли, который в сочетании с химиотерапией помогает контролировать рост опухоли (50).
Противовоспалительные макрофаги (М2-подобные)
В отличие от М1, М2 макрофаги обладают противовоспалительными и опухоль-промотирующими свойствами. М2-подобные ТАМ преобладают в распространенных опухолях, функционируя как критические регуляторы в ответ на TME. М2-подобные макрофаги представляют большую часть ТАМ во многих онкологических заболеваниях, что ассоциируется с неблагоприятным прогнозом у онкологических больных, и согласуется с их способностью благоприятствовать росту опухоли, способствовать инвазии и метастазированию рака, участвовать в неоваскуляризации, и способствовать формированию иммуносупрессорной TME (25, 52–63).
М2 макрофаги были впервые обнаружены в гельминтозной инфекции, в отличие от моноцитарных прогениторов под влиянием IL-4 и IL-13 при сильной Th2-поляризованной реакции. Хотя Th2 цитокины необходимы для M2 задействования, M2 макрофаги также секретируют цитокины, которые опосредуют Th2 ответы и регулируют воспалительные реакции (64–67).
К первичным агентам, вызывающим активацию М2 типа, относятся цитокины (4, IL-10, IL-34 и IL-13), витамин D3, TGF-β, простагландин E2 (PGE2), VEGF, EGF, глюкокортикоиды (68) и M-CSF (69). М2-подобные ТАМ далее подразделяются на IL-4/13-активированные M2a, иммунный комплекс-активированные M2b, IL-10-деактивированные M2c и, IL-6/M-CSF петля-индуцированные M2d (70) макрофаги на основании стимуляции различными цитокинами.
М2 макрофаги действуют как опухолевые промоутеры несколькими способами:
- Промотирование пролиферации и инвазии раковых клеток. EGF, секретируемый М2-подобными ТАМ, прямо стимулирует пролиферацию и инвазию раковых клеток. М2 макрофаги также могут прямо способствовать пролиферации, инвазивности и миграции клеток в раке молочной железы путем подавления экспрессии IRF (IFN regulatory factor)7 посредством mIR-1587 (71). microRNA играют решающую роль в макрофагальной активации, поляризации, инфильтрации тканей и разрешении воспаления (miR-155, miR-181 и miR-451 участвуют в М1макрофагальной поляризации, miR-146a, miR-125a и miR-145-5p вовлечены в M2 макрофагальную поляризацию (72).
- В отличие от М1-подобных макрофагов продукция NO и iNOS снижается после переключения ТАМ на М2-подобный фенотип, приводя к устранению прямого уничтожения опухолевых клеток М1 (73).
- Промотирование ангиогенеза. Секреция VEGF М2-подобными ТАМ стимулирует ангиогенез в опухолевых сайтах. В свою очередь, VEGF рецепторы на поверхности ТАМ активируют аутокринную петлю, усиливая их проангиогенные и иммуносупрессорные свойства (25), а также их М2 фенотип. ТАМ также секретируют проангиогенные хемокины (например, IL-8) и протеолитические ферменты (например, ММР и катепсины, индуцируемые IL-4) (74), которые разрушают внеклеточный матрикс (ВКМ), вызывая высвобождение ангиогенных компонентов, таких как TGF-β, VEGF и фибробластный фактор роста (FGF), которые ранее хранились в ECM в неактивном состоянии (75–77). MMP-2 и MMP-9 также повышают экспрессию VEGF раковыми клетками (76), и их экспрессия связана с большей инвазивностью опухоли и плохим прогнозом.
- Подавление активности опухоль-киллерных клеток. M2 макрофаги также играют роль в ингибировании функции NK-клеток за счет секреции ингибирующих факторов и установлением межклеточных контактов (78). Секретируя PGE2, M2-подобные макрофаги супрессируют цитотоксичность NK-клеток через гипорегуляцию NKp30, NKp44, NKp46 и NKG2D связыванием с E-простаноидными 2 (EP2) и EP4 рецепторами, ведя к иммуносупрессорному сигналингу циклический аденозинмонофосфат (цАМФ)-протеинкиназа А (PKA) в NK-клетках. PGE2 также оказывает прямое влияние на макрофаги (см. ниже). MMP, секретируемые M2-подобными макрофагами, расщепляют FASL, экспрессируемую на поверхности NK-клеток, таким образом ингибируя апоптоз опухолевых клеток, опосредованный лигированием FAS:FASL, которое играет критическую роль в иммуносупрессии. М2-подобные ТАМ также продуцируют большое количество IL-10, который ингибирует как продукцию IL-12 внутриопухолевыми дендритными клетками (DC), так и CD8+ Т-клетка-опосредованные противоопухолевые ответы (79). IL-10, подобно TGF-β, супрессирует цитотоксичность CD8+ Т-клеток и NK-клеток путем прямой транскрипционной репрессии генов, кодирующих функциональные медиаторы, такие как перфорины, гранзимы и цитотоксины. TGF-β способствует метастазированию, позволяя эпителиально-мезенхимальный транзит раковых клеток, что наделяет их более инвазивным потенциалом, ассоциированным с формированием метастазов (80). TGF-β ассоциируется с плохим прогнозом для множественных типов опухолей и является основным фактором исключения CD8+ Т-клеток из опухолей (81). М2 макрофаги также могут супрессировать Т-клеточную активацию истощением триптофана за счет повышенной экспрессии индоламин-2,3-диоксигеназы (IDO) и локального истощения L-аргинина за счет экспрессии аргиназы 1 (ARG1) (82).
- Промотирование резистентности к терапии. В нескольких исследованиях сообщалось о способности ТАМ ограничивать эффективность терапии блокадой иммунных чекпоинтов (83). М2-подобные ТАМ экспрессируют высокие уровни как PD-1, так и PD-L1, таким образом, прямо участвующие в иммунной супрессии, а также высокие уровни FcγR, которые могут подавлять терапевтические антитела, используемые для блокирования иммунных чекпоинтов (84). ТАМ, по-видимому, также ингибирует большинство противоопухолевых методов лечения, часто используемых в клинической практике, включая обычную химиотерапию, антиангиогенную терапию, и радиацию. (84) (85)
- Следовательно, высокая доля М2-подобных макрофагов в ТАМ может быть причинным фактором плохого прогноза и более короткой выживаемости пациентов для многих типов рака. У CRC пациентов увеличение доли ТАМ М2 типа ассоциировано с увеличением метастазов в печень (94).
Таким образом, M1-подобные ТАМ, которые стимулируют воспалительные реакции против опухолевых клеток, в основном обладают противораковым действием, тогда как М2-подобные ТАМ обладают противовоспалительной активностью, которая наделяет им проопухолевыми свойствами (25).
Рецепторы и сигнальные пути макрофагов, регулирующие макрофагальную поляризацию в канцере
Рецепторные сигнальные пути ведут к провоспалительным М1-подобным макрофагам
Учитывая, что TME играет главную роль в макрофагальной поляризации и что взаимодействие хемокиновых/цитокиновых рецепторов с их лигандами приводит к поляризации макрофагов, мы опишем в следующем разделе основные сигнальные пути, происходящие в М1-макрофагальной поляризации у человека через различное лиганд-рецепторное взаимодействие.
IFNγ рецепторы
IFNγR1 и IFNγR2 цепи являются членами семейства цитокиновых рецепторов II класса. Две цепи IFNγR1 первоначально связываются с IFN-γ гомодимером, индуцируя последующее включение двух IFNγR2 цепей. Обе IFNγR цепи должны соединяться с сигнальным механизмом для трансдукции своих сигналов. Внутриклеточный домен IFNγR1 имеет сайты связывания с Janus Tyrosine Kinase (JAK)1 и латентным цитозольным фактором, сигнальным трансдуктором и активатором транскрипции (STAT)1. JAK1- и STAT1-связывающие последовательности необходимы для фосфорилирования рецепторов, сигнальной трансдукции и индукции биологического ответа (Фиг. 1). Аналогично внутриклеточная область IFNγR2 содержит связывающую последовательность для задействования JAK2 киназы или тирозинкиназы 2 (TYK2) в зависимости от типа лиганда для участия в сигнальной трансдукции.
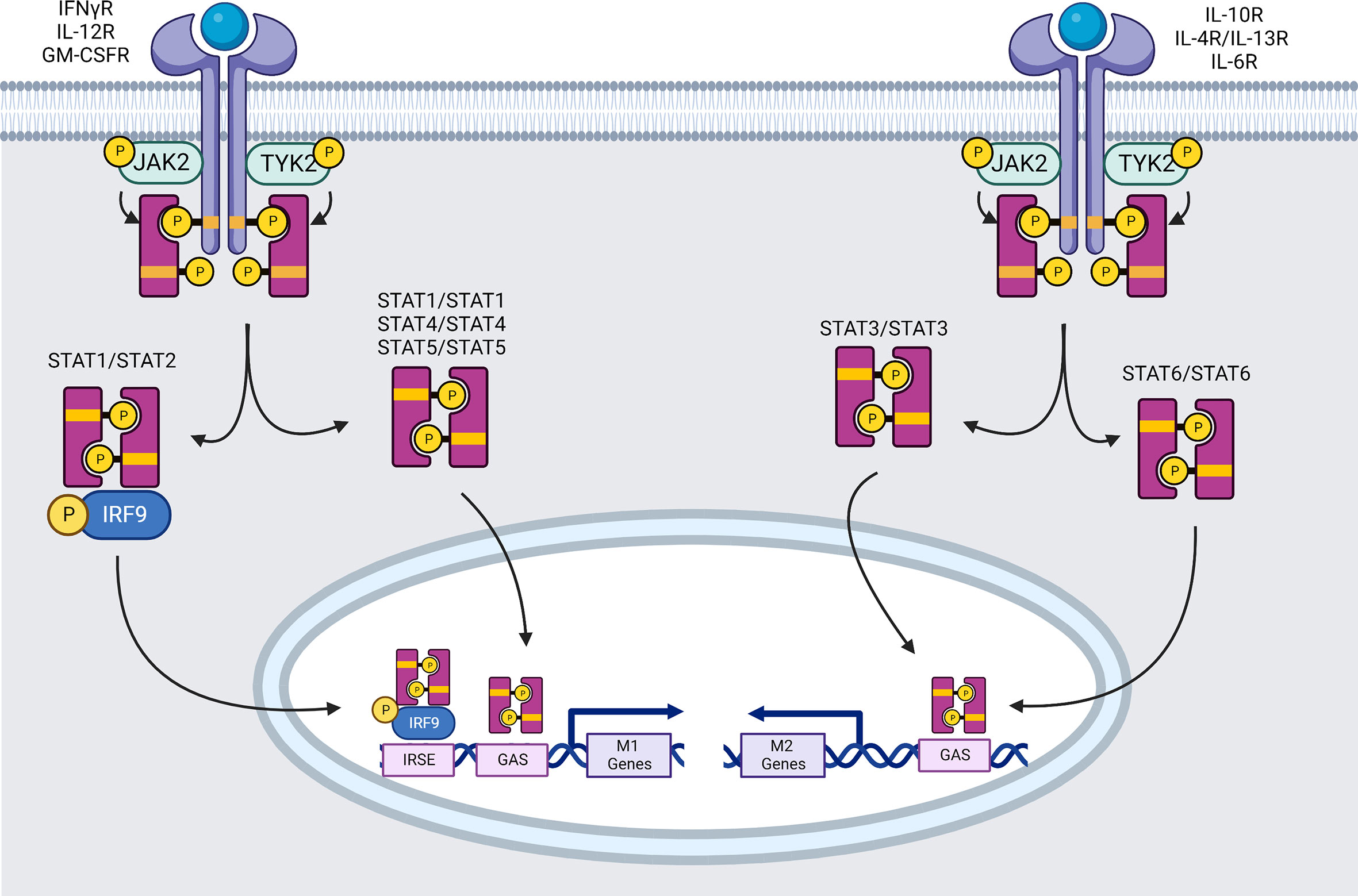
Фиг. 1. Сигнальные пути, опосредованные JAK семейством тирозинкиназ
В течение 1 минуты после провоспалительной IFN-γ-терапии фосфорилируются четыре основных нижерасположенных тирозинкиназы (JAK1, JAK2, TYK2 и STAT1) (95). Взаимодействие с лигандом приводит к аутофосфорилированию и активации JAK2, что позволяет JAK2 трансфосфорилировать JAK1 (96). Активированный JAK1 фосфорилирует функционально важный остаток Y440 каждой цепи IFNγR1, образуя два смежных стыковочных сайта для латентных SH2 (SRC homology 2) STAT1 доменов (97). Пара STAT1 фосфорилируется вблизи С-конца на Y701, скорее всего, с помощью JAK2. Фосфорилирование вызывает диссоциацию гомодимера STAT1 от рецептора (98). Диссоциированный гомодимер STAT1 достигает ядра и присоединяется к промотерным областям, позволяя или ингибируя транскрипцию генов, регулируемых IFN.
Механизм транслокации STAT1 в ядро остается неизвестным, однако предполагается участие importin-1 (NPI-1) (99). STAT1 гомодимеры связываются с ДНК в GAS-сайты в TTCN (24, 25, 52) консенсусной последовательности GAA (100), ведущей к экспрессии нескольких генов. От двух до пятисот генов активируются в ответ на IFN, включая iNOS, MIG (=CXCL9), ICAM-1 (intercellular adhesion molecule 1), IRF1 и сам STAT1 (101). Например, ICAM-1 ингибирует макрофагальную поляризацию M2 (102), и его экспрессия, по-видимому, препятствует M2-ассоциированным PI3K (phosphoinositide 3-kinase)/AKT (Ak strain transforming), снижая фосфорилирование и экспрессию PTEN (phosphatase and tensin homolog) и AKT (103). iNOS и IRF1 сильно ассоциированы с воспалением и предпочтительно экспрессируются в фенотипе M1 (104).
STAT1 также способен формировать гетеродимеры со STAT2, когда IFN I и III типов (α и λ) связываются с IFNαR1:IFNαR2 или IFNλR1:IL-10R2 соответственно. STAT2 задействуется после его активации по тирозине 466 (Y466) IFNαR1, который уже фосфорилирован TYK2. Затем STAT2 задействует STAT1, который может быть активирован только путем фосфорилирования Y701 (105). Гетеродимеры STAT1-STAT2 объединятся с IRF9 для создания ISGF3 (Interferon-stimulated gene factor 3) транскрипционного комплекса. ISGF3 распознает ISRE (IFN stimulated response elements) (консенсусная область: YAGTTTC(A/T)YTTTYCC), проутерные элементы специфических генов провоспалительных макрофагов, индуцированных интерферонами, таких как факторы, индуцируемые гипоксией (HIF)-1α (101, 106). .
Фосфорилирование STAT1 по серину (S)727 также необходимо для максимальной транскрипционной активации таргетных генов. Фосфорилирование серина STAT1 индуцируется различными стимулами, включая IFN I и II типов, LPS, IL-2, IL-12, TNF-α и тромбоцит-дериватный фактор роста. В макрофагах, например, LPS сигналинг повышает фосфорилирование STAT1 S727 независимо от фосфорилирования Y701, усиливая клеточные ответы на IFN-γ (107), таким образом способствуя поляризации M1 макрофагов.
Il-12R
IL-12 активирует наивные лимфоциты и индуцирует их дифференцировку. Однако IL-12 также способствует M1 макрофагальной поляризации, индуцируя продукцию IFN-γ Th1 клетками, что, в свою очередь, усиливает противоопухолевые цитотоксические CD8+ T- и NK-клетки (108). IL-12p40 и IL-12p35 связываются с IL-12R-β1 и -β2 соответственно, результируя в трансфосфорилирование ассоциированных JAK (JAK2 и TYK2) и затем ведут к активации и транслокации гомодимера STAT4 в ядро, где они связываются со STAT связывающими сайтами в IFN-γ промоутерах M1 таргетных генов (109, 110).
IL-12 также действует как M1 классический активирующий фактор опосредованным механизмом. IL-12 промотирует антигенную презентацию антигена, повышая экспрессию MHC-I на опухолевых клетках (111), промотируя поляризацию M1 макрофагов и задействуя эффекторные иммунные клетки путем увеличения экспрессии хемокинов CXCL9, CXCL10 и CXCL11 (112).
IL-12 has been also studied in pathological context showing again its ability to благоприятствуют M1 polarization. In fact, it has been shown that IL-12R/STAT4 drives obesity-ассоциированные insulin резистентность through pro-inflammatory M1 макрофагальная поляризация (113).
В патологическом контексте IL-12 также продемонстрировал способность благоприятствовать M1 поляризации. IL-12R/STAT4 управляет ожирение-ассоциированной резистентностью к инсулину посредством провоспалительной M1 макрофагальной поляризации (113).
Toll-подобные рецепторы и IL-1R
Эволюционно консервативное семейство Toll-подобных рецепторов (TLR) является одним из наиболее изученных семейств паттерн-расознающих рецепторов (PRR) и играет решающую роль в ранней защите хозяина от инвазируемых патогенов (40).
Среди 13 членов семейства TLR, включая трансмембранные TLR1, TLR2, TLR4, TLR5, TLR6 и TLR10, и эндосомальные TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 и TLR13, наиболее релевантные TLR, ассоциированные с макрофагальной поляризацией при канцерном контексте, являются TLR2/TLR6 (114), TLR3 (114, 115), TLR4 (115, 116) и TLR7/8 (117). TLR4, например, активирует сигнальные каскады (NF-κB и MAPK), что приводит к продукции провоспалительных цитокинов (TNFα, IL-1, IL-6, IL-12) и интерферонов I типа, необходимых для распространения воспалительного ответа.
TLR представляют собой интегральные мембранные гликопротеины I типа, которые принадлежат к более широкому суперсемейству, включающемому рецепторы IL-1, вследствие значительного сходства в их цитоплазматическом регионе, известным как Toll/IL-1R (TIR) домен. TLR/IL-1R димеризуются после связывания лиганда и подвергаются конформационному изменению, необходимому для включения провоспалительных нижерасположенных сигнальных молекул. К ним относятся адапторная молекула MyD88 (myeloid differentiation primary-response protein 88), IL-1R-ассоциированные киназы (IRAK), TGF-активируемая киназа (TAK1), TAK1-связывающий протеин 1 (TAB1), TAB2 и TNFR-рецептор-ассоциированный фактор 6 (TRAF6) (118) (Фиг. 2).
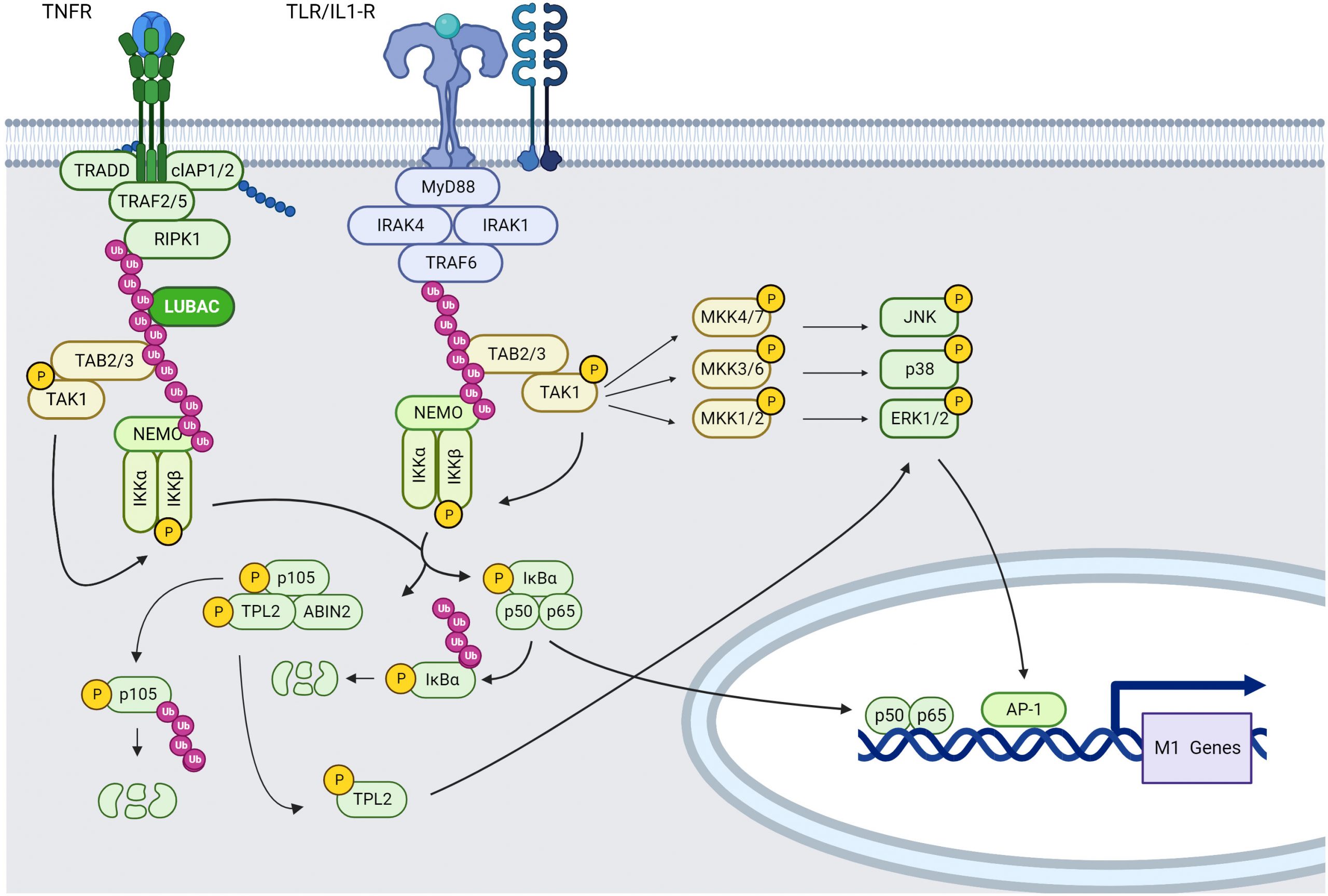
Фиг. 2. TNFR и TLR/IL-1R, NF-kB и MAPK сигнальные пути в макрофагах
TLR4, TLR2 и TLR2/TLR6 задействуют MyD88 через связывающий адаптер MAL, TLR7/TLR8 задействуют MyD88 прямо. TRIF (TIR-domain-содержащий adapter-inducing interferon-β) также задействованный опосредованно для TLR4 через связывающий адаптер TRAM (TRIF-ассоциированные adaptor molecule), TLR3 задействует TRIF прямо. TLR4 — только рецептор, который использует TRIF, TRAM, MyD88 и адаптер-подобный протеин MyD88 (MAL/TIRAP). В результате он служит моделью как для TRIF-, так и для MyD88-зависимых путей (119).
- MYD88-зависимый TLR сигнальный путь
MyD88 задействуется к цитоплазматическому домену TIR, где он повышает присоединение комплекса IRAK4-рецептор благодаря взаимодействию с гомофильным DD (Death Domain). Связывание MyD88 с IRAK4 вызывает IRAK4-опосредованное фосфорилирование остатков S376 и T387 IRAK1 и последующее аутофосфорилирование, результирующее в IRAK1 киназную активность (120, 121).