Статья для терапевтов/врачей общей практики
Глиобластома является наиболее частым первичным раком головного мозга у взрослых.[1] Несмотря на хирургическую резекцию, химиотерапию и лучевую терапию, медиана выживаемости после постановки диагноза составляет всего 14–16 месяцев.[1,2,3] Прогрессирование заболевания неизбежно и приводит к ухудшению физических и когнитивных расстройств с ранней зависимостью от поддержки со стороны лиц, осуществляющих уход [дальше ЛОУ], врачей общей практики и служб паллиативной помощи. Неспециалисты играют важную роль в раннем направлении пациентов с подозрением на опухоль головного мозга, психологической поддержке после постановки диагноза, назначении лекарств и поддерживающем уходе в конце жизни, а также в поддержке родственников погибших.
Что такое глиобластома?
Глиобластома — первичная карцинома головного мозга, которая может развиваться в любой области центральной нервной системы (ЦНС), но чаще всего локализуется в лобных или височных долях. Возникновение глиобластомы в ЦНС отличает ее от более распространенных вторичных типов рака головного мозга вследствие метастазирования из отдаленных первичных сайтов, чаще всего легких, молочной железы или кожи.[5] Глиобластома принадлежит к гетерогенному набору опухолей головного мозга, называемых глиомами, которые являются дериватами глиальных клеток или их прекурсоров и включают астроцитомы и олигодендроглиомы.[6] Первые классифицируются ВОЗ как локализованные (I степень злокачественности) или диффузные (II-IV степень), и повышение злокачественности отражает более агрессивные опухолевые фенотипы.[7] Глиобластома представляет собой диффузную астроцитому IV степени, высокозлокачественный подтип с высоким темпом клеточного деления и сосудистой пролиферации и центральными областями опухолевого некроза.[7,8]
Распространенность глиобластомы
Ежегодная заболеваемость глиобластомой составляет 3-5 случаев на 100 000 человек,[3,9,10] что соответствует в среднем 1-3 пациентам за всю карьеру врача общей практики. Хотя это заболевание может возникать у детей и взрослых, средний возраст на момент постановки диагноза составляет 65 лет.[9] У мужчин глиобластома встречается примерно в 1,6 раза чаще, чем у женщин.[3,9]
Факторы риска
Подавляющее большинство пациентов с глиобластомой не имеют идентифицируемых факторов риска развития опухоли.[11] Некоторые редкие семейные раковые синдромы, включая нейрофиброматоз 1 типа, туберозный склероз, синдром Линча и синдром Ли-Фраумени, ассоциированы с повышенным риском развития глиобластомы.[12] При подозрении на наследственный раковый синдром следует обратиться к клиническому генетику для проведения дальнейшего исследования и последующего наблюдения. Единственным установленным негенетическим риском является воздействие ионизирующего излучения в анамнезе.[13] Атопические состояния идентифицированы как защитный фактор, снижающий риск глиомы примерно на 30%.[13] Эпидемиологические данные не подтверждают связь между использованием сотовых телефонов и риском развития опухоли головного мозга.[13]
Обращение пациентов за первичной медико-санитарной помощью
Начальная презентация глиобластомы часто неспецифическая, в целом, симптомы подобны наблюдаемым в других первичных или вторичных опухолях головного мозга, а также в более распространенных доброкачественных неврологических заболеваний. Приблизительно у половины пациентов диагноз ставится после поступления в больницу скорой помощи.[14] Большинство из них обращаются, часто неоднократно, к врачу общей практики с симптомами до постановки диагноза.[15,16] Несмотря на это, только 2% пациентов в Англии в настоящее время диагностируются в пути «предполагаемый рак», который предоставляет врачам общей практики прямой доступ к магнитно-резонансной томографии (MRI) головного мозга в течение двух недель.[14,16] Это демонстрирует серьезную проблему выявления предполагаемых случаев опухолей головного мозга в первичном звене, где ранние симптомы часто аналогичны симптомам доброкачественных заболеваний. В Великобритании проведение национальной информационной кампании по улучшению распознавания ранних симптомов опухолей головного мозга у детей (HeadSmart) позволило сократить интервал от появления симптомов до установления диагноза.[17] Аналогичная стратегия для взрослых пациентов еще не создана.
Головная боль является наиболее частым ранним симптомом опухолей головного мозга (Фиг. 1), но лишь у 1-2 пациентов из 1000, обращающихся к своему врачу с этим симптомом, позже диагностируется опухоль головного мозга. Характеристики головной боли варьируют в зависимости от локализации, размера и скорости роста опухоли [21,22] и может носить тип напряжения или мигрени. Головная боль усиливаются в положении лежа на спине и поэтому наиболее выражена при пробуждении. Она также может вызываться кашлем или пробой Вальсальвы. Головная боль имеет тенденцию к нарастанию частоты или тяжести с течением времени. Появление дополнительных неврологических симптомов в сочетании с головными болями значительно повышает вероятность наличия опухоли головного мозга (Фиг. 1). Например, сообщение о новой головной боли наряду со слабостью или когнитивной дисфункцией повышает вероятность опухоли головного мозга в 44 и 59 раз соответственно.[18]
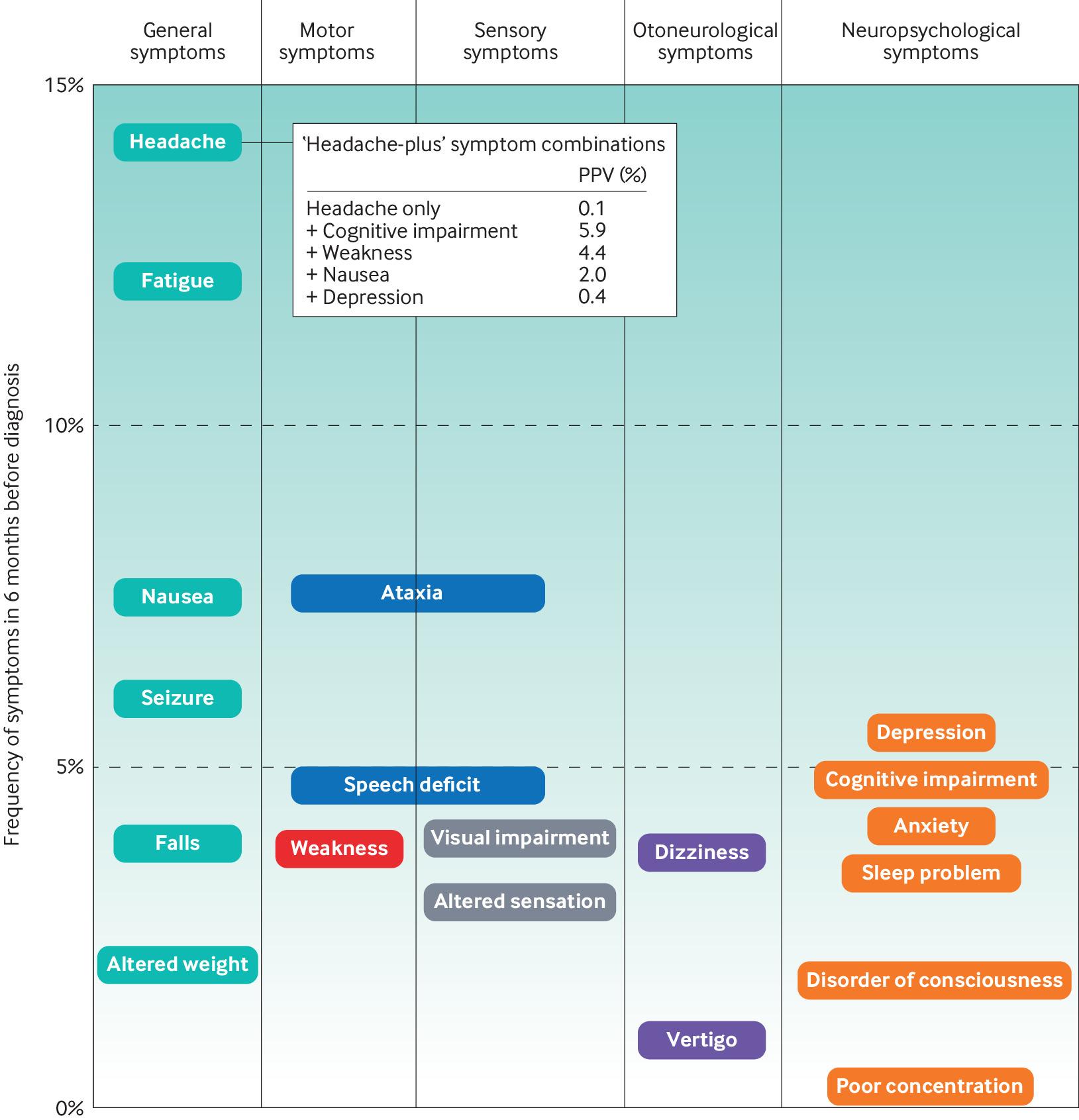
Фиг. 1. Частота симптомов, сообщаемых врачам общей практики за 6 месяцев до постановки диагноза опухоли головного мозга. Адаптировано из Ozawa et al. [18]
Судороги наблюдаются примерно у 20% пациентов с глиобластомой, и еще у 20% судороги развиваются на более поздних стадиях болезни. [11,23] Несмотря на менее распространенную презентацию в первичной медико-санитарной помощи, новые эпилептические припадки во взрослом возрасте имеют наибольшую положительную прогностическую ценность (positive predictive value, PPV) среди всех отдельных симптомов (1,6%), за которыми следуют моторная слабость (1,5%) и спутанность сознания (1,4%).[18] Другие симптомы, ассоциированные с опухолями головного мозга (Фиг. 1) имеют PPV <1% каждый. [18] Комбинации симптомов, особенно в случае прогрессирования, значительно повышают вероятность идентификации внутричерепной опухоли на MRI [24,25].
Первоначальная оценка
История
Устанавливается характер и временное прогрессирование имеющихся симптомов. Сопутствующий анамнез членов семьи, друзей или коллег по работе может быть информативным, поскольку пациенты часто не замечают тонких изменений в своей личности или поведении во времени.[26] Недавнее исследование пациентов с диагнозом опухолей головного мозга показало, что большинство пациентов и членов их семей замечали множественные легкие признаки или «изменения» (например, «У меня затуманилось в голове», «Вы были не совсем в себе»), по меньшей мере, за несколько месяцев до их первоначального обращения.16 Поэтому важно просмотреть записи о последних консультациях и дать возможность пациентам, которые не были направлены на обследование, вести дневник симптомов и возвращаться, если они чувствуют, что что-то по-прежнему не так.[16,18]
У пациентов с головной болью распознаются клинические признаки высокого риска, которые вызывают подозрение на возможную опухоль головного мозга (Вставка 1). Выясняются перенесенные злокачественные опухоли, факт облучения или семейный анамнез наследственных раковых синдромов, которые независимо повышают вероятность диагноза опухоли головного мозга.[28–29] Очаговые неврологические дефициты, ассоциированные с опухолями головного мозга, типично нарастают постепенно в течение недель или месяцев; острый дефицит чаще связан с цереброваскулярной ишемией или кровоизлиянием в опухоль. При истории возможных судорог, узнается предшествующая им аура, характер судорог, а также прикусывание языка, недержание мочи, постиктальная спутанность сознания и слабость. Судороги височной доли часто незамечаются, поскольку они представляют собой резкое изменение поведения пациента, а не тонико-клонические движения конечностей. Им может предшествовать ощущение аномального запаха или вкуса или ощущение вздутия живота. При подозрении на судороги в анамнезе пациентам следует рекомендовать прекратить вождение автомобиля до подтверждения диагноза специалистом. Членам семьи или ЛОУ следует дать рекомендации по оказанию первой помощи, как распознать судороги и справиться с ними в дальнейшем.
Вставка 1. Черты головных болей высокого риска, ассоциированных с опухолями головного мозга*
- Головная боль, вызванная кашлем, пробой Вальсальвы, чиханием или физической нагрузкой
- Ортостатическая головная боль (усугубляется в положении лежа на спине)
- Существенное изменение характеристик головной боли
- Ассоциированные с новым неврологическим дефицитом, изменением личности или когнитивной дисфункцией
- Нарушенный уровень сознания
- Рвота без другой очевидной причины
- История злокачественного новообразования, для которого характерно метастазирование в головной мозг
* Адаптировано из NICE clinical guideline CG150 — Headaches in over 12s: diagnosis and management [27]
Обследование
Выполняется неврологическое обследование черепных нервов и двигательной, сенсорной и церебеллярной систем. Пациентам с симптомами, указывающими на повышенное внутричерепное давление, оцениваюся состояния дисков зрительных нервов на наличие признаков их отека или выполняется цифровая фотография сетчатки. Рутинное использование когнитивных скрининговых тестов, таких как Mini Mental State Examination (MMSE) или Montreal Cognitive Assessment (MoCA), не рекомендуется, поскольку они не обладают достаточной сенситивностью для выявления тонких доменоспецифических нейрокогнитивных дефицитов у пациентов с глиобластомой.[30,31]
Дифференциальный диагноз
Дифференциальный диагноз варьирует в зависимости от продолжительности, хронологической последовательности и анатомической локализации симптомов. Из-за неспецифического характера проявлений опухолей головного мозга ряд различных неврологических состояний следует рассматривать как альтернативные диагнозы или сопутствующие расстройства. У пациентов с установленным диагнозом первичной головной боли (таких как головная боль напряжения или мигрень) дневник симптомов помогает установить, произошли ли существенные изменения в частоте или характеристиках головной боли, требующие дальнейшего исследования.
Проведение исследований
Если пациенты презентуют симптомы повышенного внутричерепного давления (например, головная боль с отеком диска зрительного нерва), их направляют в местное отделение неотложной помощи для обследования в тот же день и первоначального проведения контраст-усиленной компьютерной томографии (CT) головы. Наличие в анамнезе вероятных новых судорог, предполагает срочное направление к специалисту, имеющему опыт в эпилепсии (например, в «first fit» клинику) для подтверждения диагноза и дальнейших обследований (MRI головы с контрастным усилением или электроэнцефалограмма).[32] Для пациентов с предполагаемой опухолью головного мозга, у которых отсутствуют признаки повышенного внутричерепное давление или возможная судорожная активность, срочно проводится MRI головного мозга (включая Т1-взвешенное и Т2-взвешенное изображения до и после контрастирования гадолинием, FLAIR и DWI-последовательности),[29,33] с использованием ургентного алгоритма «предполагаемый рак», где это возможно. В условиях ограниченных ресурсов или у пациентов с противопоказаниями к MRI (например, имеющих девайсы, несовместимые с MRI, или тяжелой клаустрофобией) контраст-усиленная CT головы является менее сенситивной, но хорошей альтернативой.
Маршрут доступа к ургентной нейровизуализации зависит от географического региона. В Англии NICE (National Institute for Health and Care Excellence) рекомендует врачам общей практики направлять пациентов старше 24 лет с «прогрессирующей подострой потерей центральной неврологической функции» для срочного прямого доступома к MRI сканированию головного мозга в течение двух недель.[34] Напротив, Национальная служба здравоохранения Шотландии рекомендует срочное направление к специалисту (например, к нейроонкологу), который при необходимости назначит нейровизуализацию.[35] Информируйте пациентов о направлении с предположением на рак, но также дайте уверенность в том, что у большинства из них впоследствии не будет диагностирован рак.[34]
Пациенты, презентущие первичную головную боль и отсутствие признаков высокого риска, также могут требовать сканирования для исключения серьезной основной причины их симптоматики.[36] Это представляет значительную дилемму для врачей общей практики, которые должны балансировать необходимость ограничения ненужных обследований с озабоченностью нераспознавания опухоли головного мозга. Помимо ограниченности ресурсов, следует избегать проведения нейровизуализации у пациентов без клинического подозрения на опухоль головного мозга вследствие риска гипердиагностики и редких побочных эффектов (анафилаксии на контрастные вещества и пр.). Приблизительно 1 из каждых 37 MRI сканов головного мозга выявляет случайную аномалию [37], которая может требовать дальнейшего специализированного лечения или наблюдения (например, аневризма, арахноидальная киста, менингиома).
В то время как сканирование может сократить использование услуг при головных болях у пациентов с высоким уровнем психологической заболеваемости, оно не приводит к длительному снижению симптомов головной боли или тревоги.[38] Неизвестно, отразится ли более ранняя нейровизуализация пациентов с глиобластомой, у которых изначально были головные боли, в изменении клинического исхода. Таким образом, пациентам без показаний к срочной нейровизуализации следует предложить поддержку и обязательство вернуться, если симптомы сохраняются или ухудшаются, или если развиваются дополнительные клинические симптомы.
Классическим представлением глиобластомы на MRI является объемное образование с периферическим усилением контраста на Т1-взвешенных изображениях (нарушение гематоэнцефалического барьера), центральной гипоинтенсивностью на Т2-взвешенных изображениях (некроз) и гиперинтенсивным окружением на Т2-взвешенных и FLAIR (fluid attenuated inversion recovery) изображениях, представляющие вазогенный отек или опухолевый инфильтрат (Фиг. 2).[39] Дополнительные режимы, такие как DWI (diffusion weighted imaging), помогают отличить глиобластому от других объемных образований с контрастным усилением, таких как абсцесс или лимфома ЦНС.[39] Перфузионная MRI и аминокислотная позитронно-эмиссионная томография (PET) может использоваться для выявления метаболических горячих точек (hotspots), подходящих для тканевой биопсии, как альтернатива хирургической резекции [29].
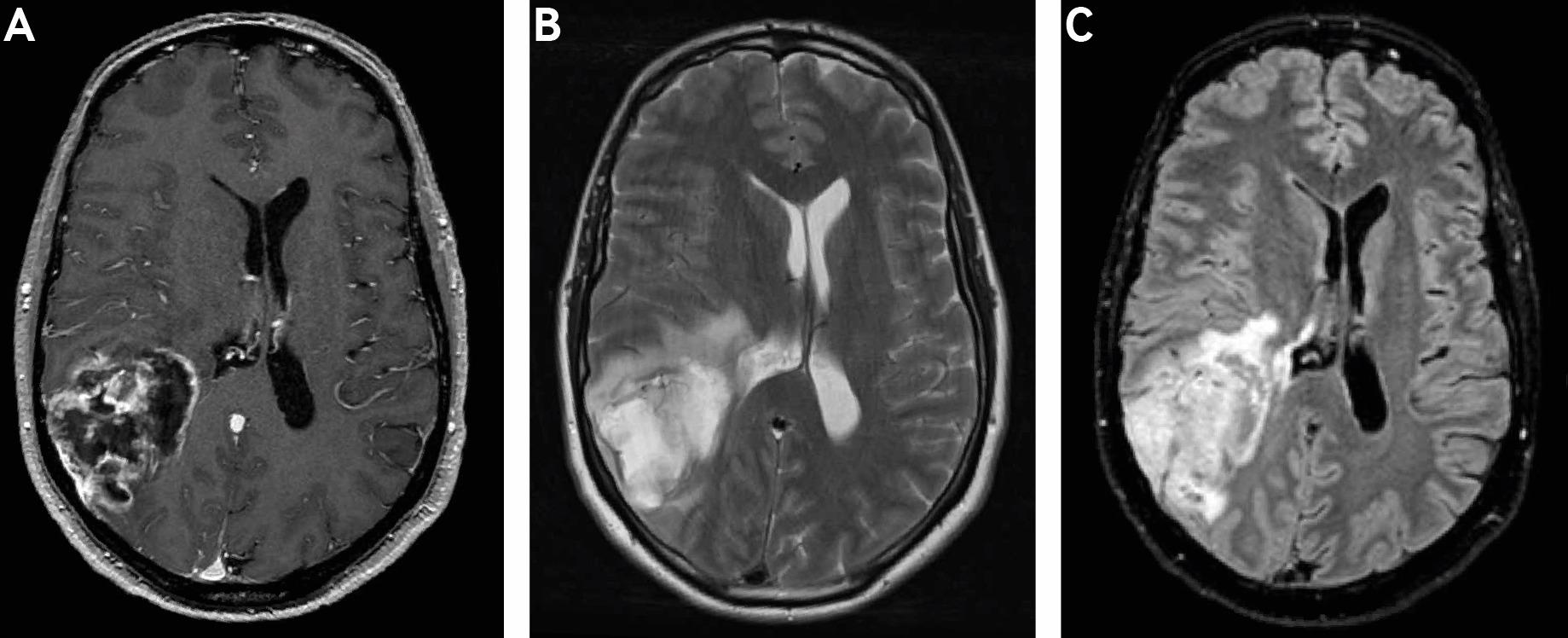
Фиг. 2. Аксиальное MRI сканирование головы с (A) гадолиний-усиленным T1-взвешенным изображением, (B) T2-взвешенным изображением и (C) FLAIR последовательностями, демонстрирующими глиобластому в правой теменной области
Лечение глиобластомы
Если визуализация продемонстрирует предполагаемую опухоль головного мозга, пациент направляется в специализированную многопрофильную нейроонкологическую бригаду для подтверждения диагноза и дальнейшего лечения (Фиг. 3) [33]. При подозрении на глиобластому лечение первой линии заключается в проведении максимальной хирургической резекции для локального контроля над опухолью перед адъювантной терапии.[29] Дополнительно к получению ткани для гистопатологической диагностики хирургическое вмешательство направлено на улучшение неврологической функции, облегчение отказа от стероидов, продление выживаемости и улучшение качества жизни [29, 40]. У пациентов пожилого возраста, с плохим функциональным статусом или с опухолью, не поддающуюся хирургической резекции, мультидисциплинарная команда может рассматривать менее инвазивную процедуру биопсии. считается.[29,33] Если риск биопсии считается слишком высоким или прогноз, вероятно, будет очень неблагоприятным, рассматривается только поддерживающая терапия или короткий курс паллиативной лучевой терапии. [29]
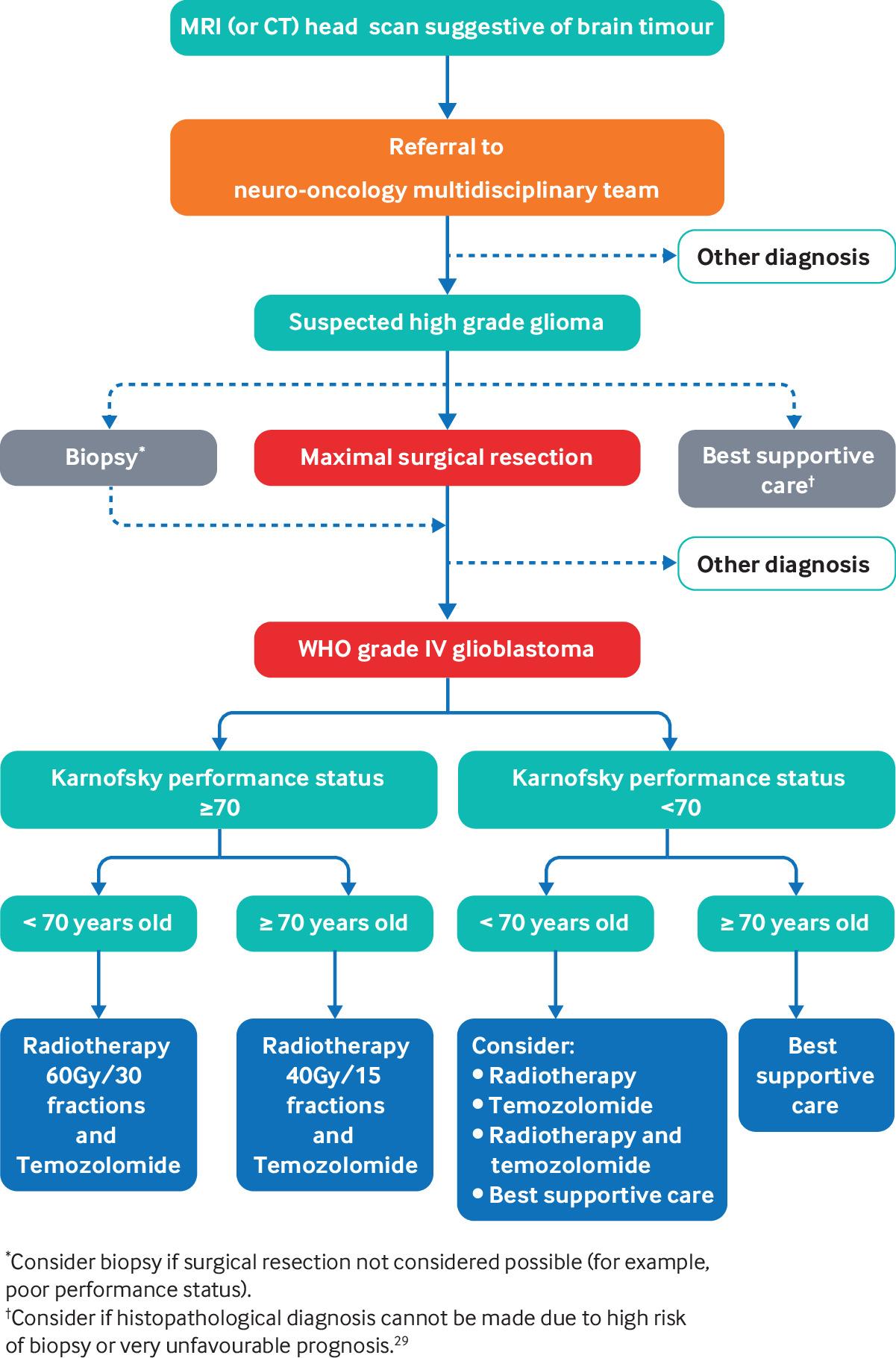
Фиг. 3. Алгоритм лечения глиобластомы. Адаптировано из NICE guideline NG99 [33]
Недавний систематический обзор и метаанализ показали, что более расширенная резекция улучшает выживаемость у пациентов с глиобластомой [41]. Однако интраоперационное повреждение важных зон мозговой ткани, которые отвечают за контроль движений, ощущений или речи, ассоциированы со снижением качества жизни и общей выживаемости.[42] Для увеличения объема резекции и снижения к минимуму риска послеоперационной инвалидизации, разработаны различные хирургические адъюванты, включающие интраоперационные нейроанатомические навигационные системы, ультразвук, флуоресцентные красители для визуализации опухолевой ткани и картирование коры головного мозга у бодрствующих пациентов. [29]
Биопсийные образцы опухолей классифицируются и градируются согласно классификации ВОЗ для опухолей ЦНС, которая была обновлена в 2016 г. [последнее обновление в 2022 – прим.] для включения различных молекулярных маркеров дополнительно к микроскопической картине.[7,43] Для глиобластомы важно генетическое отличие между опухолями с мутациями и без них в генах, кодирующих метаболический фермент изоцитратдегидрогеназу (IDH). Несмотря на схожие гистологические проявления, глиобластома со статусом «IDH дикого типа» имеет более агрессивный фенотип, чем глиобластома с IDH мутацией (медиана выживаемости 15 месяцев против 31 месяца соответственно) [44].
Дальнейшее лечение после резекции или биопсии зависит от возраста пациента и функционального состояния (Фиг. 3) [29,33]. Стандартный протокол лечения для пациентов в возрасте до 70 лет, способных к самостоятельному самообслуживанию (то есть с функциональным статусом Карновского ≥70) представляет собой ежедневную фракционированную лучевую терапию в течение шести недель с одновременным и адъювантным темозоломидом, пероральной алкилирующей химиотерапией в течение максимум шести месяцев.[2,29,33] Пожилым пациентам с аналогичным функциональным статусом может быть предложен сокращенный курс гипофракционированной лучевой терапии с одновременным и адъювантным темозоломидом на срок до 12 месяцев.
У пациентов с глиобластомой IDH дикого типа ответ на химиотерапию темозоломидом можно предсказать по статусу метилирования промотора MGMT (the O6-methylguanine DNA methyltransferase) гена, кодирующего фермент ДНК репарации, который антагонизирует действует алкилирующей химиотерапии.[43] Таким образом, эпигенетический сайлесинг в опухолях с метилированным MGMT промотором обеспечивает повышенный ответ на темозоломид и улучшенную выживаемость в сравнении с незначительными эффектами в опухолях с неметилированным MGMT промотором.[29,33,45]
Прогноз заболевания
У взрослых в возрасте до 70 лет, которые не прошли лечения, медиана выживаемости составляет примерно 3–4,5 месяца. [3,46] Процедура биопсии с последующей химиотерапией с или без лучевой терапии повышает среднюю выживаемость примерно до 8–10 месяцев.[3,46,47] Лечение хирургическим удалением опухолевой массы с последующей химиолучевой терапией повышает медиану времени выживания примерно до 15-16 месяцев; ассоциированные показатели выживаемости составляют 27-31% через 2 года и 7-10% через 5 лет.[3,46,47]
Ожидается, что пожилые пациенты, получающие только наилучшую поддерживающую терапию, будут иметь медиану выживаемости менее 4 месяцев.[1] У пациентов в возрасте старше 65 лет, перенесших биопсию или резекцию, гипофракционированная лучевая терапия и химиотерапия имеют большую медиану выживаемости 7-9 месяцев по сравнению с только лучевой терапией.[45] Несмотря на доказательства преимущества в выживаемости, добавление адъювантной химиотерапии не улучшает качество жизни в этой группе.[45] Вследствие некурабельной природы глиобластомы пациентов необходимо надлежащим образом проинформированы о потенциальном влиянии побочных эффектов лечения на качество жизни, а не только о потенциальном повышении выживаемости, особенно у пожилых пациентов и пациентов с плохим функциональным статусом, у которых особенно неблагоприятный прогноз.
Какие поддерживающие препараты могут потребоваться?
Кортикостероиды
Подавляющее большинство пациентов с глиобластомой получают кортикостероиды во время болезни. Это лечение может облегчить головную боль, тошноту и рвоту за счет уменьшения перитуморального вазогенного отека и масс-эффекта.[23] Дексаметазон является предпочтительным выбором и может использоваться до операции, если нет подозрения на первичную церебральную лимфому или воспалительное ЦНС поражение (поскольку стероиды могут усложнять диагностику).[29] Нет единого мнения об оптимальной дозировке, а потребность в стероидах варьирует в зависимости от размера опухоли, локализации, перитуморального отека и симптомов.
Поскольку пациенты с глиобластомой часто могут оставаться на кортикостероидах в течение нескольких месяцев, они подвержены повышенному риску длительных побочных эффектов. Стероид-индуцированная гипергликемия является распространенным побочным эффектом, который усугубляет гипергликемию у пациентов с установленным диабетом и может вести к возникновению диабета у пациентов без предшествующего заболевания.[48] Цель должна заключаться в использовании стероидов в течение короткого периода времени и, если у пациентов сохраняются симптомы, снизить до минимально возможной поддерживающей дозы, которая контролирует симптомы. Пациентам, регулярно принимающим кортикостероиды, рекомендуется защита желудка ингибитором протонной помпы или антагонистом Н2-рецепторов. Пациентам, которым требуется длительная кортикостероидная терапия, рассмотривается возможность назначения бисфосфонатов для снижения риска остеопороза.
Противоэпилептические препараты
Противоэпилептические препараты рекомендуются для пациентов, перенесших судороги, но отсутствуют хорошие свидетельства в поддержку их профилактического использования [11,29,49,50]. Национальные клинические руководства рекомендуют выбирать лекарственную форму с учетом различных факторов, включая возраст и тип судорог.[32,51] Предпочтительны нефермент-индуцирующие противоэпилептические препараты (такие как леветирацетам, ламотриджин) во избежания их взаимодействия с химиотерапией и кортикостероидами.[50] Некоторые противоэпилептические препараты могут быть неэффективны у пациентов с глиобластомой вследствие потери сенситивности рецепторов или экспрессии протеинов мультилекарственной резистентности, что может результировать в рефрактерную эпилепсию.[51,52] Леветирацетам часто является препаратом первого выбора в большинстве нейроонкологических центров, поскольку он обычно хорошо переносится, может быть начат перорально в терапевтической дозе, не требует мониторинга и, видимо, не зависит от протеинов мультилекарственной резистентности.[23,50,51,52] Отсутствует консенсус относительно оптимальной продолжительности терапии пациентов с глиобластомой, поэтому многие клиницисты предпочитают назначать противоэпилептические препараты на неопределенный срок, если они хорошо переносятся.[53] Любое решение об прекращении их применения должно учитывать анамнез, остаточную опухоль, ожидаемый рост опухоли, побочные эффекты препаратов и предпочтения пациента.[53]
Венозная тромбоэмболия
Пациенты с глиобластомой имеют повышенный риск венозной тромбоэмболии в периоперационном периоде и позже с 1-годичным инцидентом около 20%.[54] Большое рандомизированное двойное слепое исследование пациентов после плановой нейрохирургии, большинство из которых имели опухоли головного мозга, показало, что профилактическое введение низкомолекулярного гепарина (LMWH) эффективно снижает частоту венозных тромбоэмболий без увеличения риска геморрагических осложнений.[55] Однако отсутствуют хорошие свидетельства в поддержку продолжения профилактического приема LMWH после выписки [11,23]. Если у пациентов с глиобластомой развивается венозная тромбоэмболия, терапевтическая антикоагулянтная терапия обычно считается безопасной, если не было недавней геморрагии из опухоли или химиотерапия-ассоциированной тромбоцитопении.[11,56] LMWH обычно предпочтительнее для лечения венозной тромбоэмболии у пациентов с глиобластомой.[50] Антикоагулянтную терапию продолжают в течение 3-6 месяцев, но лечение следует продлить у пациентов, получающих химиотерапию.[50]
Когнитивные расстройства и нарушения настроения
Приблизительно у 9 из 10 пациентов с опухолями головного мозга перед началом лечения наблюдается когнитивный дефицит.[57] Это, вероятно, усугубляется канцер-ассоциированной слабостью и нарушением сна.[11] Рандомизированные контролируемые исследования (RCT) на сегодняшний день не показали положительного эффекта ингибиторов ацетилхолинэстеразы или психостимуляторов в степени снижения когнитивных функций или симптомов слабости в этой группе.[11,56] Депрессия может наблюдаться у 1 из 5 пациентов с глиомой.[58] На сегодняшний день ни в одном RCT не изучалась эффективность фармакологического лечения депрессии в этой группе пациентов.[59]
Советы по сопровождению
Информируйте пациентов с недавно диагностированной глиобластомой, что они не должны садиться за руль и должны уведомить орган, выдающий водительские удостоверения, о своем состоянии. После лечения суждение о том, способен ли пациент снова начать водить машину, основывается не только на истории эпилептических судорог, но и на наличии любого неврологического или когнитивного дефицита.[50]
Наблюдение за пациентами
Последующее наблюдение обычно координируется нейроонкологом и дает возможность контролировать физическое и психологическое состояние пациентов и ЛОУ. Вследствие риска миелосупрессии общий анализ крови проводится еженедельно у пациентов, получающих химиолучевую терапию, и ежемесячно у пациентов, получающих только адъювантную терапию темозоломидом. Также рекомендуются ежемесячные исследования функции почек и печени. Если опухоль локализуется близко к гипоталамусу или гипофизу, рекомендуются эндокринное тестирование для контроля функции гипоталамо-гипофизарной оси.[60] Повторная нейровизуализация является критической для определения ответа на лечение и мониторинга рецидива заболевания. Базовое гадолиний-усиленное MRI головного мозга проводится через 24–48 часов после операции.[29] Обычно его сравнивают с повторным MRI через 1–3 месяца после завершения лучевой терапии для определения первоначального ответа на лечение. График клинического обследования и последующих визуализаций обычно составляется с интервалом в 3 месяца или раньше, в зависимости от объема остаточной опухоли, ответа на лечение, предпочтений пациента и ожидаемой продолжительности жизни.[33]
Если перед следующим осмотром у пациента усиливаются головные боли или появляется новый очаговый неврологический дефицит, необходимо срочное клиническое обследование для определения необходимости повторного MRI (или CT) сканирования.[33]
Лечение рецидива заболевания
Несмотря на хирургическую резекцию и химиолучевую терапию, глиобластома неизбежно рецидивирует.[61] До 80% рецидивов опухоли возникают в пределах 2 см от исходного очага опухоли; остальные возникают в отдаленных областях головного мозга, что предполагает микроскопическую инвазию опухолевых клеток за пределы исходного края резекции.[61,62] Рекуррентная глиобластома часто более агрессивна и менее сенситивна к лечению, чем первоначальная опухоль.[61] Дальнейшие варианты лечения остаются на усмотрение нейроонкологической междисциплинарной команды, которая принимает во внимание фенотип опухоли, время, прошедшее с момента последнего лечения, предпочтения пациента и состояние здоровья.[33] Если рецидив является локальным, повторная хирургическая резекция может быть вариантом.[33] Когда рассматривается дальнейшая химиотерапия, может использоваться ломустин или комбинированная терапия прокарбазином, ломустином и винкристином (PCV).[33] Также может рассмотриваться включение в клиническое исследование.[29] Дальнейшая лучевая терапия также может быть опцией в зависимости от времени, прошедшего с момента первоначального лечения, и локализации заболевания.[33] Ранние результаты рандомизированных испытаний показывают, что этот подход может пролонгировать выживаемость без прогрессирования без улучшения общей выживаемости.[63] Если пациент отказывается от продолжения лечения или дополнительная болезнь-модифицирующая терапия вряд ли принесет клиническую пользу, предпочтение отдается активному паллиативному подходу.[33]
Типичный опыт болезни пациентов с глиобластомой и лиц, ухаживающих за ними
Пациенты с глиобластомой имеют архетипические траектории физического, социального, психологического и экзистенциального дистресса, которые начинаются до подтверждения диагноза.[64] Падение социальных навыков может следовать той же схеме, что и физических, тогда как психологический и экзистенциальный дистресс обычно остро проявляются на четырех стадиях: после постановки диагноза, после первоначального лечения, при прогрессировании болезни и в конце жизни. Мы определяем экзистенциальные или духовные вопросы как относящиеся к смыслу и цели жизни.[65] Индивидуальное протекание глиобластомы варьирует в зависимости от других факторов, включая сопутствующие заболевания и наличие индивидуальных семейных и общественных ресурсов (например, личностная устойчивость и эмоциональная поддержка). Как описано в случае прогрессирующего рака легкого,66 пациенты и члены их семей, осуществляющие уход за пациентами с глиобластомой, могут подвергаться «американским горкам», испытывая тревогу и дистресс (Фиг. 4).
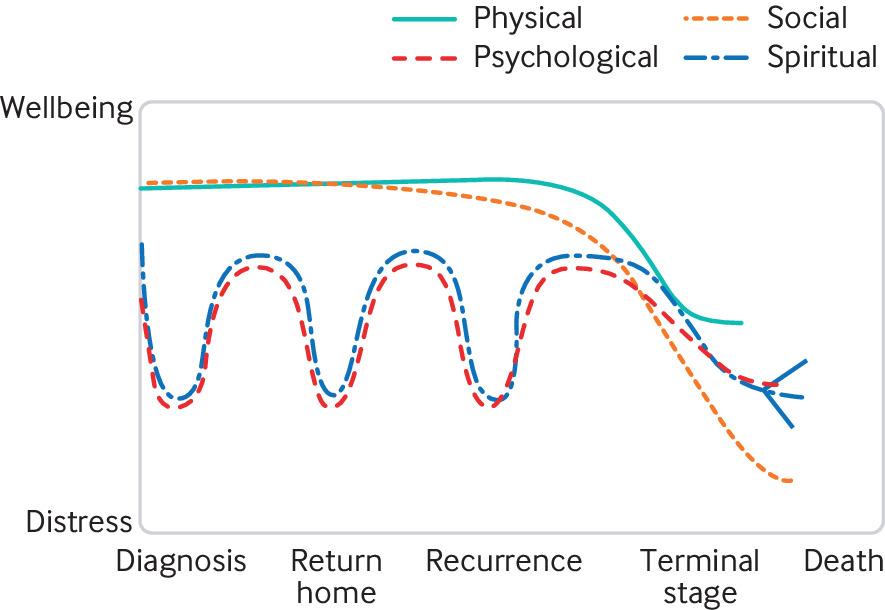
Фиг. 4. Типичные флюктуации траекторий физического, социального, психологического и духовного здоровья у больных глиобластомой и их родственников. Адаптировано из Murray et al [66]
Понимание этого типичного опыта болезни позволяет специалистам в области здравоохранения и социальной помощи прогнозировать вероятные потребности своих пациентов и ЛОУ, чтобы они могли обеспечить соответствующую поддержку и чуткое и эффективное общение с ЛОУ, начиная с момента постановки диагноза и заканчивая поддержкой в связи с тяжелой утратой (вставка 2). Раннее предоставление паллиативной помощи врачами общей практики и клиницистами в больнице, а не только специалистами по паллиативной помощи, может существенно улучшить качество жизни и смерти пациентов, у которых диагностирована глиобластома, и ЛОУ.