Введение
Ангиогенез или аберрантная васкуляризация считаются являются характерным признаком солидных опухолей (Hanahan and Weinberg 2011) [1,2,3,4], так и признаком рецидива опухоли [5]. Опухоли кровоснабжаются на ранней стадии своего развития [6], когда достигают размера более нескольких миллиметров [7]. Кровеносные и лимфатические сосуды также связуют раковые клетки с новыми опухолевыми сайтами, т. е. метастазами [8].
Эндотелиальные клетки (EC) известны как важнейшие участники опухолевого ангиогенеза и снабжения опухолевых клеток кислородом и нутриентами [11]. Каждая EC может поддерживать рост примерно 2000 опухолевых клеток [12].
Опухолевые сосуды происходят от трех различных источников: (1) ангиогенез или спраутинговый ангиогенез, который определяется ростом новых кровеносных сосудов из ранее существовавшей сети сосудов и их прорастанием в опухоль, (2) васкулогенез, который также называется неоангиогенезом и характеризуется формированием сосудов de novo из опухоль-задействованных костный мозг-дериватных эндотелиальных прогениторных клеток (EPC) [13, 14] и (3) кооптация сосудов , которая определяется манжетообразной организацией раковых клеток вокруг уже существующей сосудистой сети [13, 15] (Фиг. 1). Ангиогенез является наиболее распространенной формой, которая возникает в опухолях в основном как ответ на гипоксию опухолевой (TME). Ангиогенез подразделяется на классический спраутинг, гломерулоидный и инвагинальный (intussusceptive) микроваскулярный рост. Гломерулоидный ангиогенез представляет собой развитие сосудов в гломерулоподобные структуры, а инвагинальный рост представляет собой продольное расщепление ранее существовавших сосудов [16].
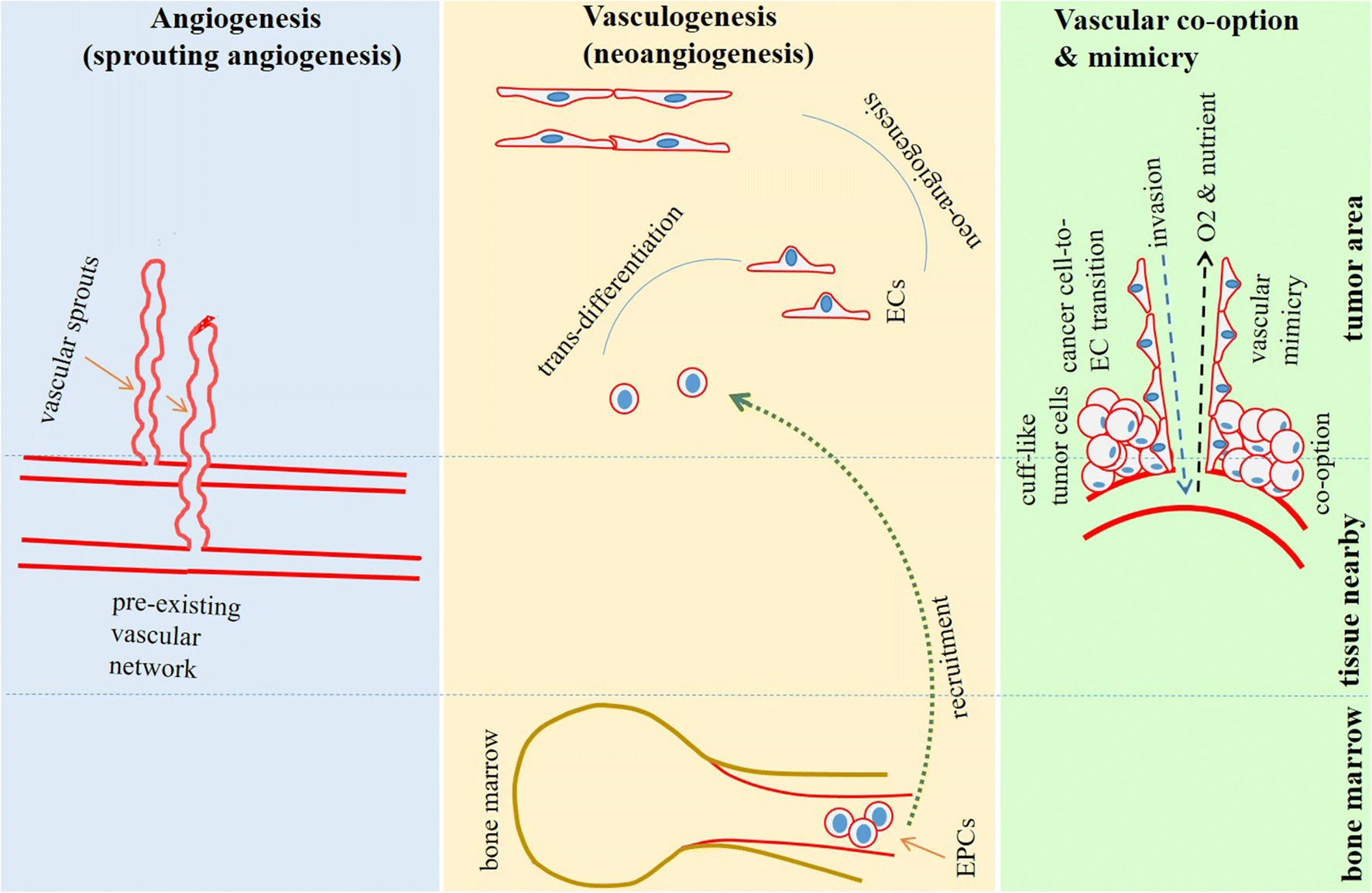
Фиг. 1. Происхождение опухолевых сосудов. Опухоли используют 4 основных типа роста сосудов: ангиогенез, васкулогенез и сосудистая кооптация и мимикрия. Ангиогенез характеризуется сосудистыми отростками (спраутов) из уже существующей сосудистой сети, васкулогенез основан на задействовании эндотелиальных прогениторных клеток (EPC) из костного мозга в опухолевую область и их дальнейшей трансформации в эндотелиальные клетки (EC). Кооптация сосудов — это процесс, происходящий в канцере, например, в головном мозге, легких и печени, во время которого раковые клетки образуют манжетообразные структуры вокруг уже существующей сосудистой сети. Сосудистая мимикрия представляет собой каналообразную структуру эндотелиоподобных клеток, дериватных раковых клеток, которая помогает опухолям удовлетворять свои метаболические потребности и потребности в кислороде. Кроме того, они могут служить путем опухолевого метастазирования
Архитектура опухолевой сосудистой сети
Опухолевые сосуды имеют аномальную и незрелую архитектуру [17]. Они демонстрируют интенсивный спраутинг, вместе с неравномерно извилистой манерой влечет повышение резистентности потока. Опухолевые сосуды также отличаются большими порами в стенках (диаметром от 400 до 600 нм [18]), что характерно для негерметичной или гиперпроницаемой сосудистой сети. Пористая архитектура различается внутри и между опухолями, и приобретение такого признака в основном связано с дефектом базальной мембраны и плохим развитием плотных контактов между EC. Базальная мембрана опухолевой сосудистой сети неравномерна по составу и толщине, может быть слишком толстой или даже отсутствовать. Опухолевые сосуды также хрупкие и тупоконечные. Диаметр опухолевой сосудистой сети варьирует от аномально широких до необычно тонких каналов с маленькими или даже сжатыми просветами.
Таким образом, нет фактической связи между диаметром сосуда опухоли и скоростью кровотока вследствие неоднородной сосудистой сети, вызывающей функциональное шунтирование через опухолевую сосудистую сеть. Опухолевые сосуды также имеют общие характеристики артериол, венул и капилляров, но не проявляют отличительной идентичности. Эта функция вызывает обширные шунты между артериальной и венозной системами опухоли (анатомические шунты). Иногда в опухолевой сосудистой сети встречается многослойность. Гладкомышечные клетки (SMC) могут отсутствовать, а стенка опухолевых кровеносных сосудов может быть интегрирована с раковыми клетками. Кроме того, опухолевые сосуды имеют ограниченное покрытие перицитами. В норме перициты должны присутствовать в достаточном количестве, чтобы стабилизировать новообразованные сосуды, направлять оптимальный кровоток и ограничивать дальнейший спраутинг.
Перициты поддерживают стабильность микрососудистую сеть, способствуя созреванию сосудов. В опухолях перициты аномально рыхло обертываются вокруг эндотелия, называются отслоившимися перицитами, или могут даже отсутствовать. Активность перицитов важна для поддержания функции и целостности опухолевой сосудистой сети, и, таким образом, их отсутствие и отслоение от опухолевого эндотелия может усиливать диссеминацию опухоли. Низкая доля перицитов в опухолях по сравнению с нормальными тканями, возможно, способствует незрелой опухолевой сосудистой сети. Эта аномальная опухолевая сосудистая сетьявляется следствием дисбалансом в сигналинге, связанные с про- и антиангиогенезом, результатом чего является пространственная и временная гетерогенность кровотока и некогерентная перфузия.
Типичным проявлением такой некогерентной перфузии является низкий кровоток и последующая гипоксия и ацидоз в TME, а также высокое давление интерстициальной жидкости (IFP) (также называемое интерстициальной гипертензией). Такая неадекватная перфузия и высокий IFP могут оказывать сильное опосредованное влияние на прогрессирование опухоли, включая иммуносупрессию, резистентность к терапии (лучевая и химиотерапия) и метастазирование [4, 9, 10, 14, 19,20,21,22,23,24,25, 26,27,28,29,30,31]. Архитектурные аномалии опухолевой сосудистой сети могут иметь диагностическое значение, т. е. реакцию пациента на антиангиогенную терапию можно оценить с помощью архитектурной визуализации опухолевой сосудистой сети [32]. Полезным инструментом для этого является ультразвуковое исследование с контрастным усилением. Васкулярная пенетрация может быть оценена таким образом со специфичностью ~ 88,6 % для диагностики злокачественных новообразований. Оценка внутриопухолевой дилатации у пациентов с раком молочной железы может повысить надежность диагностики до ~ 89 % [33] (Фиг. 2).
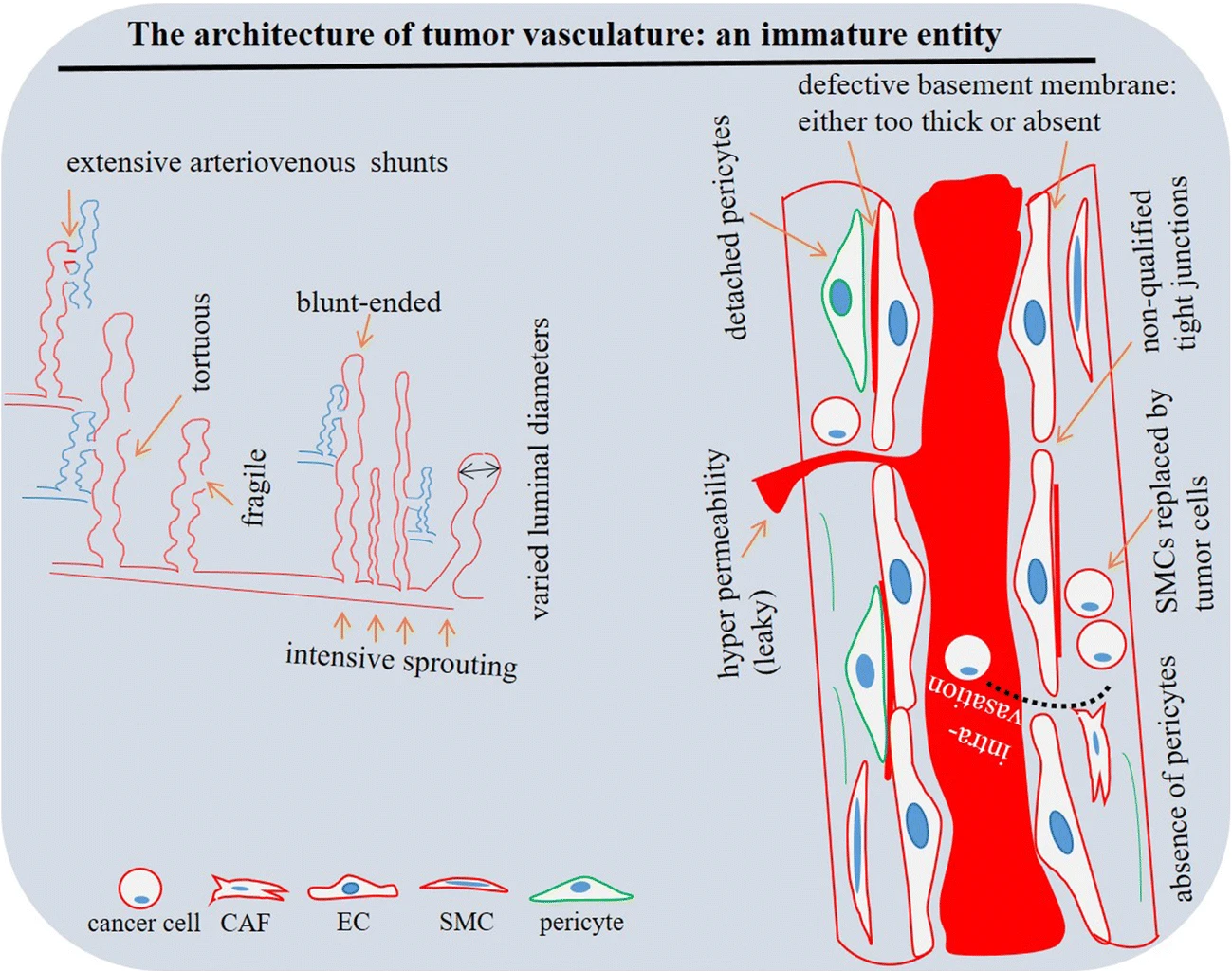
Фиг. 2. Архитектура опухолевой сосудистой сети. Показаны характеристики опухолевой сосудистой сети, отличающие от ее нормальных сосудов. Перициты и гладкомышечные клетки (SMC) — периваскулярные клетки, расположенные вокруг эндотелия опухоли. Перициты либо обособлены, либо отсутствуют. Отслоение перицитов связано с негерметичной опухолевой сосудистой сетью. Отслоившиеся клетки могут дифференцироваться в канцер-ассоциированные фибробласты (CAF), которые, в свою очередь, участвуют в инвазии раковых клеток и их интрузии из «текущих» сосудов в кровоток.
Кровоток в опухолях
Кровоток во многих солидных опухолях дезорганизован. В норме артерии имеют более высокое давление, чем вены, при этом скорость кровотока прямо пропорциональна от артерий к венам и обратно пропорциональна геометрической резистентности. Напротив, в опухолях существует небольшая разница в давлении между артериями и венами, вызывающая увеличение показателя геометрической резистентности [27]. Фактически аберрантный кровоток и сосудистая проницаемость ведут к конститутивному депонированию плазмы во внеклеточном матриксе (ECM), что называется вазогенным отеком [34]. ECM существует с дисфункциональными лимфатическими сосудами или даже не имеет этих сосудов. Например, в метастатической меланоме лимфатические сосуды менее часты или почти отсутствуют по сравнению с таковыми в первичной опухоли, с обширной микронеоваскуляризацией в метастазах [35].
Лимфатические сосуды подвергаются конститутивной компрессии растущей опухолью, превращая их в аномальные или неправильно функционирующие сосуды. Аномальные лимфатические сосуды препятствуют эффективному клиренсу и дренированию избыточной плазмы во внеклеточное пространство. Повышение IFP, по сути, является результатом неправильной работы лимфатической системы наряду с повышенной проницаемостью опухолевой сосудистой сети [30, 36]. Это повышение IFP может достигать 5–10 мм рт. ст. или даже выше и может вызывать снижение трансваскулярного градиента гидростатического давления почти до нуля, тем самым препятствуя распространению крупных молекул и препятствуя диффузии системной доставки препаратов и нутриентов в TME [30, 37, 38]. Высокий IFP также может быть результатом повышенных депозитов гиалуроновой кислоты в строме внеклеточного матрикса. Гиалуронидазы можно использовать для таргетинга высокого IFP, и они являются эффективным подходом к разрушению опухолевого ECM [39, 40].
Высокий IFP сдавливает существующую сосудистую сеть крови в опухолях, так что кровоток отклоняется от центра опухоли к краю или периферии опухолевой массы [27]. Поток крови от ядра к краю ограничивает лекарственную аккумуляцию препаратов в опухоли [41]. Такой переход от ядра к краю также может быть связан с клеточностью опухоли. Раковые стволовые клетки (CSC) являются примером в этом контексте. Liu и его коллеги в инвазивной карциноме молочной железы оценивали наличие CD44+ CSC в трех областях опухоли: нижней передней части (центральная область), промежуточной области и инвазивной передней части (краевая область). Они заметили низкое присутствие CD44+ CSC в сердцевине, более высокую долю в промежуточной зоне и самую высокую долю в краевой области [42]. Это привело к концепции перехода CSC от ядра к краю, и критическим промотором этого процесса является гипоксия [41, 43]. Это означает, что опухолевые клетки, включая раковые клетки и CSC, при переходе от ядра к краю будут иметь большую резистентность к терапии. Поскольку край опухоли является местом для инвазивных адаптивных опухолевых клеток, чаще всего местом для терапии резистентных CSCs, оправдано полное удаление краевого участка, без чего следует ожидать рецидива. Из-за проницаемости аберрантная опухолевая сосудистая сеть будет способствовать нарастанию гипоксии и, таким образом, клеточному транзиту (Фиг. 3).
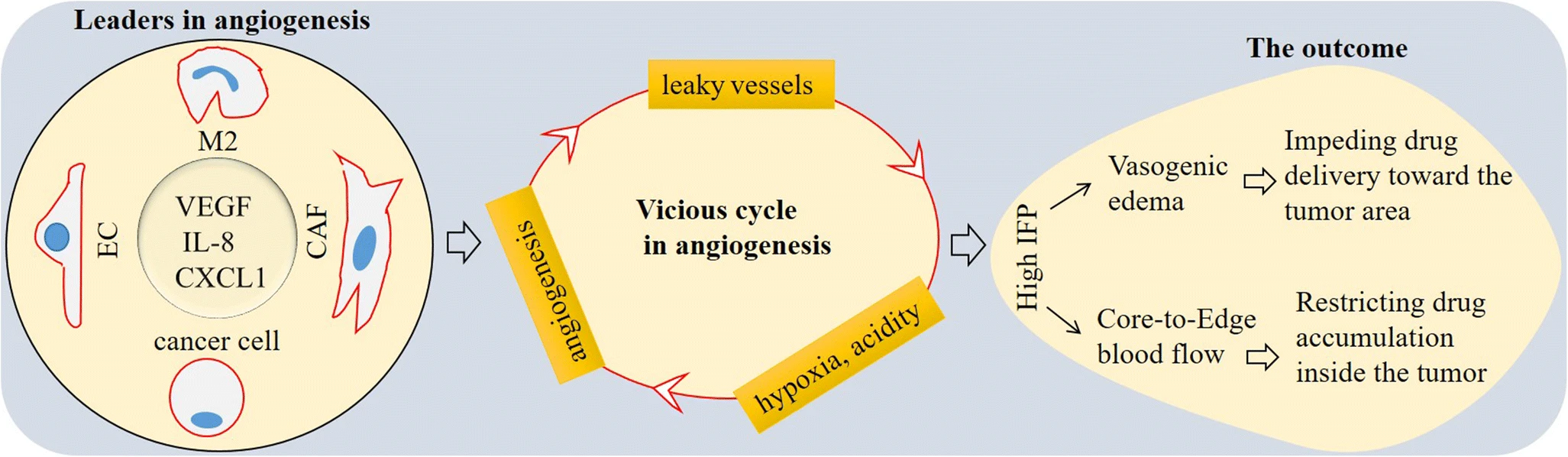
Фиг. 3. Ангиогенез, порочный цикл в ангиогенезе и его значение для резистентности к химиотерапии. Четыре участника ангиогенеза в опухолевой микросреде (TME): канцер-ассоциированные фибробласты (CAF), раковые клетки, макрофаги 2 типа (М2) и эндотелиальные клетки (EC). Вследствие аномальной архитектуры опухолевой сосудистой сети степень гипоксии и кислотности в опухоли нарастает, что еще больше увеличивает скорость интерстициального давления жидкости (IFP). Высокий IFP препятствует доставке препарата в область опухоли и ограничивает аккумуляцию препарата в опухолях
Периваскулярные клетки и опухолевый ангиогенез
Перициты и SMC — периваскулярные клетки, окружающие EC [44]. Перициты обычно поддерживают жизнеспособность EC и индуцируют образование плотных контактов между ними [45]. В туморогенный статусах, EC рыхло покрыты перицитами [46], что приводит к слабому развитию плотных контактов между tumorigenic и, как следствие, к негерметичной архитектуре. Перициты в TME являются частично деривативами CSC и способствуют иммуносупрессии [47] и резистентности к химиотерапии [47]. Перициты защищают эндотелий от антиангиогенной терапии [5]. Перициты, диссоциированные или отслоившиеся от опухолевой сосудистой сети, подвергаются дифференцировке в фибробласты, что способствует инвазии и метастазированию опухоли [48]. Отслойка перицитов инициирует васкулярную дестабилизацию, генерацию и миграцию верхушечных клеток [49] (Фиг. 2).
Активность перицитов хорошо определена в глиобластоме (GBM). GBM имеет гемато-опухолевый барьер (BTB) на границе между кровью и опухолевыми клетками. В BTB отсутствуют плотные соединения из-за аномальной функции перицитов в его структуре. По сравнению с гематоэнцефалическим барьером (BBB) BTB является более проницаемым, что позволяет проникать метастатическим опухолевым клеткам в область головного мозга. Удивительно, но BTB также оснащен переносчиками оттока для препятствования проникновению противоропухолевых препаратов в область опухоли [45, 50, 51]. По-видимому, часть однонаправленной эффлюксной насосной активности в периваскулярных нишах обусловлена активностью CSC. CSC представляют собой один из компонентов периваскулярных ниш [31] и могут образовываться из периваскулярных клеток путем переключения фенотипа [52], свидетельствуя, что периваскулярные клетки обладают пластичностью для формирования клеток, необходимых для опухолевой прогрессии. CSC также могут быть привлечены в эти ниши через сигнальную ось CXCL12 (C-X-C chemokine ligand 12)/CXCR4 (C-X-C chemokine receptor type 4) [53]. Таким образом, CSC могут подвергаться дифференцировке в перициты, которую преимущественно промотирует влияние трансформирующего фактора роста-β (TGF-β) [31]. Блокирование этого плеотропного иммуносупрессивного цитокина ингибирующими препаратами имеет решающее значение для подавления роста и прогрессирования рака [54, 55].
Перициты, дериватные CSC в пределах периваскулярной ниши, участвуют в поддержании структуры и функции BTB. Фактически, способность препарата к оттоку BTB может усиливаться под влиянием CSC-дериватных перицитов. Таким образом, CSC и CSC-дериватные перицитоподобные клетки могут быть мишенями для повышения проницаемости опухоли для химиотерапевтических препаратов, основным механизмом действия которых является поломка BTB [50]. Таргетинг CSC и дериватных от них перицитов также могут быть эффективным подходом для разрушения неососудистой сети опухоли и для подавления роста опухоли [31]. Существует большое перекрытие в экспрессии биомаркеров между перицитами и SMC, что указывает на тесную кооперацию между двумя типами клеток в формировании новых кровеносных сосудов. Oct4 считается маркером CSC. Интересно, что нокаут Oct4 в периваскулярных клетках (SMC + перицитах) подавляет ангиогенез [44]. Эти данные показывают, как CSC связаны с промотированием ангиогенеза в периваскулярных нишах.
Фактор роста сосудистого эндотелия: ключевой промотор (спраутингового) ангиогенеза
Фактор роста сосудистого эндотелия (VEGF) — воспалительный и регуляторный цитокин, который известен как основной компонент и критический драйвер ангиогенеза. VEGF действует как промоутер роста кровеносных сосудов [56, 57], так и стимулятор сосудистой проницаемости [58, 59]. Кровеносные сосуды образуются в ответ на VEGF-A, тогда как лимфатические сосуды образуются в ответ на VEGF-C и VEGF-D. Так, VEGF-A известен как индуктор гематических EC, а VEGF-C и VEGF-D — как индуктор лимфатических EC [60]. VEGF-A представляет собой циркулирующую форму и обычно упоминается как VEGF. VEGF-A является основным медиатором ангиогенеза в подавляющем большинстве солидных опухолей [61, 62]. Напротив, роль VEGF-B в ангиогенезе ограничена некоторыми органами, такими как сердце. VEGF-B промотирует рост сердечной сосудистой сети, не вызывая побочных эффектов, таких как повышенная проницаемость, как это наблюдается в опухолевой сосудистой сети [15]. Как правило, VEGF-B поддерживает новые кровеносные сосуды [62]. VEGF существует в виде связанных с матриксом или растворимых изоформ. Матрикс-связанная изоформа стимулирует васкулярное ветвление, растворимая изоформа промотирует расширение сосудов [15]. Последнее происходит благодаря образованию подвижных EC, называемых верхушечными клетками (см. выше). Tip-клетки развиваются в ответ на высокий градиент VEGF-A [10] (Фиг. 4).
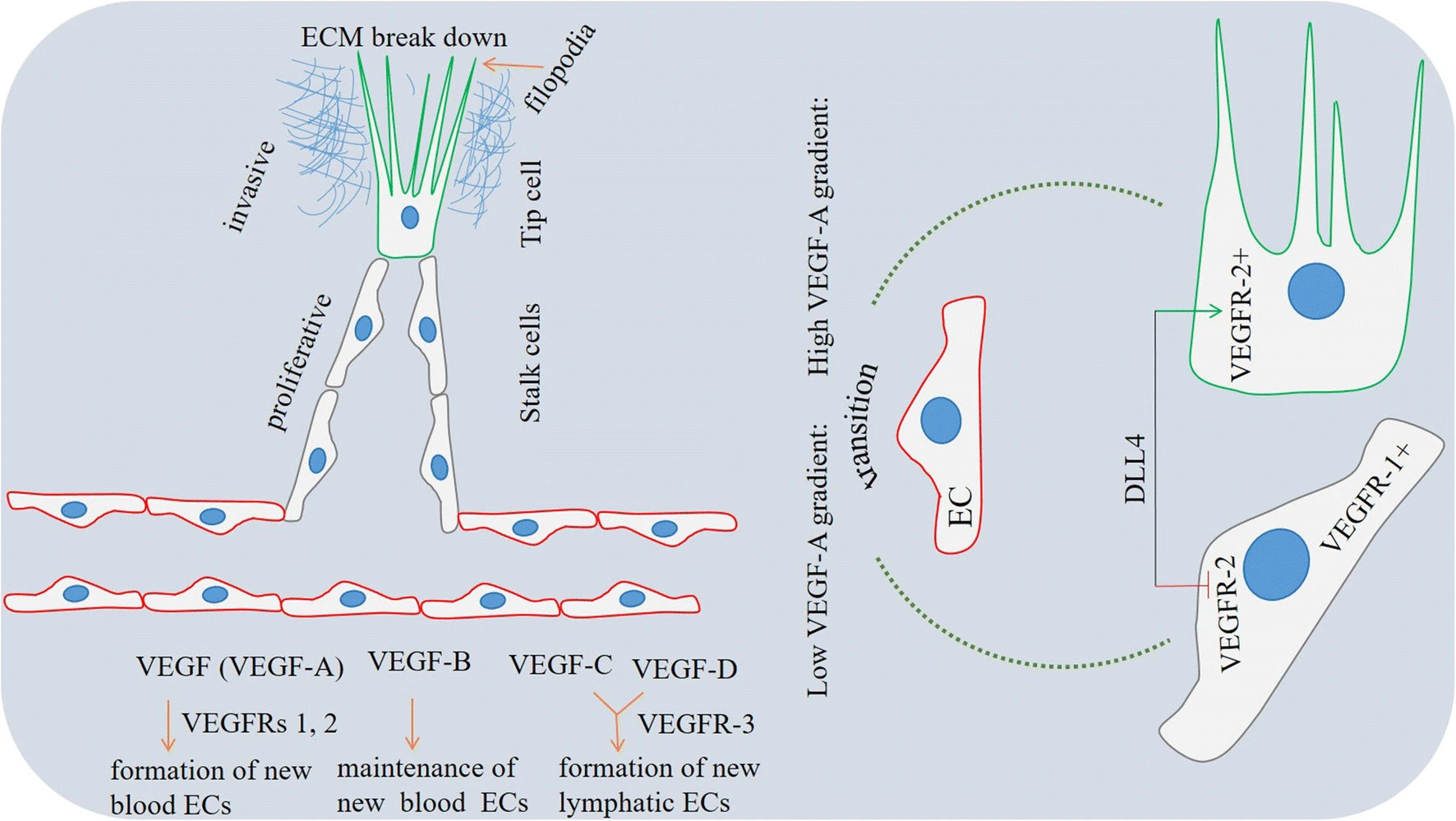
Фиг. 4. Васкулярный спраутинг в опухолях: механизм селекции верхушечных (tip) и стволовых (stalk) клеток. Tip-клетки являются мигрирующими клетками с филоподиями для разрушения внеклеточного матрикса (ECM) и дифференцируются из эндотелиальных клеток (EC) под действием высоких градиентов фактора роста сосудистого эндотелия (VEGF)-A. Tip-клетки прокладывают путь пролиферирующим stalk-клеткам для удлинения новообразованных сосудистых спраутов. Эти клетки трансформируются из EC при низком градиенте VEGF-A. Спецификация любого из двух фенотипов находится под контролем Notch сигналинга. Высокая активность DLL4 (delta-like 4) в EC при коммитировании верхушечных клеток делает их высокочувствительными к VEGF-A за счет усиления экспрессии VEGFR-2, тогда как активность Notch-сигналинга в EC, подвергшихся трансформации стволовых клеток, вызывает низкую экспрессию VEGFR-2, что делает их нечувствительными к VEGF-A.
Раковые клетки, макрофаги 2 типа (М2), канцер-ассоциированные фибробласты (CAF) и EC являются четырьмя ключевыми клетками, ответственными за высвобождение VEGF в опухолевой строме (рис. 3). Аутокринное высвобождение VEGF из EC способствует поддержанию васкулярного гомеостаза, в то время как его паракринное высвобождение из раковых клеток и других клеток в опухолевой строме отвечает за васкулярную ветвление, формируя опухолевую сосудистую сеть аномальной. VEGFR-1 (также называемый FLT1), VEGFR-2 (также называемый FLK1) и VEGFR-3 являются тремя известными рецепторами VEGF [15]. Активность VEGFR-1 зависит от контекста и может оказывать негативное влияние на VEGFR-2. VEGF-C и VEGF-D способствуют лимфангиогенезу посредством связывания с VEGFR-3 [24].
Селекция tip/stalk клеток в опухолевом ангиогенезе: роль сигналинга фактора роста сосудистого эндотелия/Notch
VEGF-A функционирует связыванием с VEGFR-1 и VEGFR-2. Среди двух рецепторов VEGFR-2 играет преобладающую роль в стимуляции митогенеза EC и сосудистой проницаемости [24]. VEGFR-2 в высокой степени экспрессируется на верхушечных клетках, тогда как VEGFR-1 преимущественно экспрессируется на стволовых клетках [28]. Взаимодействия между VEGF-A и VEGFR-2 в высоком градиенте VEGF-A делают возможной трансформацию EC-tip клеток, тем самым приобретая мигрирующий фенотип. Напротив, при низком градиенте VEGF-A соседние EC коммитируются в стволовые клетки, таким образом, приобретая пролиферативный фенотип [63, 64]. Верхушечные клетки являются подвижными и инвазивными EC (так называемый мигрирующий фенотип) и способны разрушать прилегающий ECM выпячиванием филоподий. Таким образом, верхушечные клетки способствуют росту новообразованных васкулярных спраутов [10]. Стволовые клетки, с другой стороны, преимущественно подвергаются пролиферации. Таким образом, отростки филоподий редко наблюдаются в стволовых клетках по сравнению с верхушечными клетками. Стволовые клетки создавают просвет и поддерживают удлинение сосудистых отростков. После того как сосудистые спрауты сформируются, приобретут просвет и удлинятся, следующим этапом будет формирование сосудистых петель, опосредованная развитием анастомозов между верхушечными клетками и ближними спраутами [28] (Фиг. 4).
Спецификация любого фенотипа (tip или stalk клетки) находится под контролем Notch сигналинга. VEGFR-2-положительные EC (конечные верхушечные клетки) демонстрируют повышенную экспрессию DLL4 (Delta-like 4). DLL4 — Notch лиганд, который при связывании со своими рецепторами на соседних EC (конечные stalk клетки) вызывает высвобождение внутриклеточного домена Notch (NICD). Это необходимо для десенситизации конечных stalk клеток к VEGF-A и опосредована сниженем VEGFR-2 экспрессии в клетках [65]. Таким образом, блокаду VEGF-A/VEGFR-2 можно использовать для нормализации опухолевой сосудистой сети, как описано ниже. Блокада внутри этой оси будет подавлять сосудистую проницаемость, тем самым уменьшая IFP, улучшая оксигенирование опухоли и увеличивая доставку препарата в опухолевую область [59] (Фиг. 4).
Опухолевая сосудистая сеть, распространение опухолевых клеток и лекарственная резистентность
Опухолевые EC экспрессируют FASL, который ограничивает инфильтрацию CD8+ Т-клетками [21]. Гиперпроницаемая опухолевая сосудистая сеть вызывает аккумуляцию побочных и конечных продуктов и повышает кислотность TME, тем самым создавая для опухолевых клеток крайне неблагоприятную среду [66]. На ранних стадиях или в предметастатическом поражении эпителиальных опухолей инфильтрация сосудов редко наблюдается. Это связано с наличием базальной пластинки, которая выполняет функцию барьера между опухолевыми клетками и окружающей васкулярной стромой. Напротив, злокачественные опухоли демонстрируют стромальный ответ, который устраняет ограничение или барьер между васкулярной стромой и опухолью и является инициатором развития васкулярной сети. Тип и степень опухоли влияют на интенсивность стромального ответа [10].
Следует учитывать, что низкое покрытие опухолевых сосудов перицитами и возникающая в результате аберрантная архитектура наряду с быстрой скоростью пролиферации EC в TME делают эти EC более чувствительными к радио/химиотерапии по сравнению с нормальными EC [12, 31]. Действие аберрантных опухолевых сосудов на окружающее TME может, таким образом, вторично обусловливать терапевтическую резистентность. Следствиями являются усиление гипоксии и более высокий IFP. Лучевая терапия наряду с некоторыми химиотерапевтическими препаратами преимущественно зависит от продукции O2 радикалов для уничтожения опухолевых клеток. Следовательно, гипоксия опухоли, являющаяся вторичным ответом на аберрантный ангиогенез, может снижать эффективность таких терапевтических подходов [15]. Это, наряду с выведением из кровотока химиотерапевтических препаратов, требует использования повышенных количеств препаратов для эрадикации опухолевых клеток. Это приводит к повышению токсичности нормальных тканей и ограничению доставки эффективных доз облучения, что, в свою очередь, приводит к прерыванию курса противораковой терапии [67, 68] (Фиг. 3).