Опухолевая оксигенация, отражающая распределение парциального давления кислорода (О2) (рО2 значения) или концентрации О2, является результатом доступности О2 (поставки О2) в опухолевую ткань, диффузионного потока О2 из микрососудов в клетки и скорости/степени респирации (скорости потребления О2) паренхиматозными и стромальными клетками, составляющими ткань. Доставка О2 в основном зависит от эффективности микроциркуляторного кровотока, диффузионного потока О2 (преимущественно зависит от дистанции диффузии) и концентрации гемоглобина в крови (cHb) у пациентов с анемией.
Характеристики
В то время как в нормальных тканях снабжение О2 удовлетворяет метаболические потребности, во многих солидных опухолях степень респирации может перевешивать недостаточную доставку О2 и приводить к развитию тканевых областей с очень низкими уровнями О2 (гипоксия), вплоть до полного лишения О2 (аноксия).
В большинстве солидных опухолей человека оксигенация нарушена по сравнению с нормальными тканями, которые характеризуются «нормальным» распределением парциального давления O2 (нормоксия). В границах одной опухоли оксигенация может быть экстремально гетерогенной в пространстве и во времени («4-D-гетерогенность») (внутриопухолевая гетерогенность). Кроме того, между опухолями одинакового клинического размера, стадии, степени злокачественности или гистологического типа наблюдается значительная гетерогенность гипоксических областей (межопухолевая гетерогенность). Обеспечение опухоли кислородом не регулируется в соответствии с метаболической потребностью, как это имеет место в физиологической ситуации.
В среднем медианные значения рО2 в опухолях существенно ниже (<10 мм рт.ст.), чем в нормальных тканях (>25 мм рт.ст.) в сайте опухолевого роста (Фиг. 1). В целом, опухолевая оксигенация не зависит от клинического размера, стадии, степени, гистологии и различных онкологических параметров или демографических данных пациентов. Для некоторых типов рака статус оксигенации значительно ухудшается при анемии (в результате снижения кислородной емкости крови) и концентрации гемоглобина выше медианного уровня (вследствие реологических проблем в хаотичных опухолевых микрососудах). Метастатические поражения, по-видимому, имеют статус оксигенации, сравнимый с первичными опухолями, тогда как локальные рецидивы имеют более низкий статус оксигенации, чем первичные опухоли.
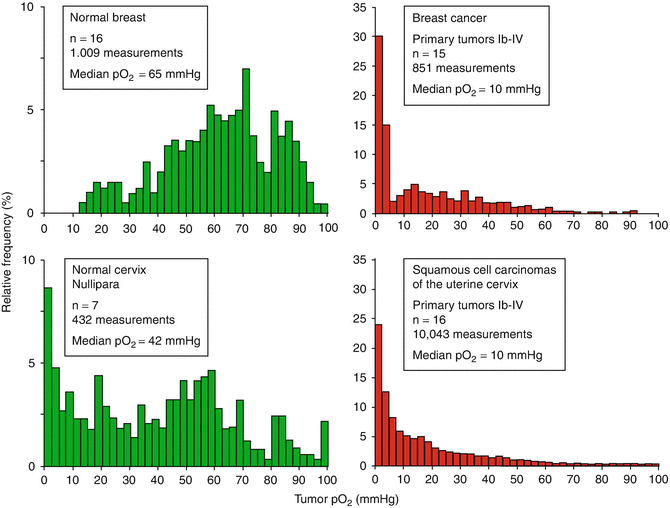
Фиг. 1. Статус оксигенации нормальных тканей (левые панели) и солидных опухолей (правые панели). Частотные распределения измеренных значений рО2 (гистограммы рО2) для нормальной ткани молочной железы и шейки матки сравниваются с соответствующими раковыми тканями (клинические стадии Ib–IV). Парциальное давление кислорода (pO2) в тканях измеряли с помощью компьютеризированного полярографического микросенсорного метода, который позволяет прямо оценивать pO2 данные O2-сенситивным игольчатым электродом. Парциальное давление кислорода измеряли вдоль нескольких дорожек электродов в каждой отдельной опухоли. Представленные здесь объединенные данные получены из измерений перед лечением у пациентов в сознании.
Патомеханизмы опухолевой гипоксии
Опухолевая гипоксия является результатом неадекватной доставки О2 к дышащим опухолевым и стромальным клеткам. Ограниченная и даже отсутствующая доставка О2 обусловлена выраженными структурно-функциональными микроциркуляторными аномалиями, а также нарушением диффузионной геометрии. Кроме того, канцер-ассоциированная и/или терапия-индуцированная анемия и формирование карбоксигемоглобина (у часто курящих) могут вести к снижению содержания О2 в крови. В результате в солидных опухолях существуют области с очень низкими (вплоть до нуля) парциальными давлениями О2. Эти микрорегионы с очень низким рО2 гетерогенно распределены в опухолевой массе и могут располагаться рядом с областями со значениями рО2, соответствующими нормальной ткани, из которой произошла опухоль. В опухолях также наблюдаются значительные временные вариации статуса оксигенации. Таким образом, опухолевая гипоксия очень динамична со сложными, быстро меняющимися градиентами кислорода.
Основываясь на лежащих в основе механизмах и их продолжительности, были описаны два основных типа гипоксии: хроническая и острая гипоксия (см. Таблицу 1).
Таблица 1. Причины хронической и острой опухолевой гипоксии
| A. Хроническая гипоксия | |
| Синонимы | Непрерывная, диффузионно-ограниченная, устойчивая, длительная |
| Причины (патогенез) | 1. Диффузия-ограниченная гипоксия |
| Увеличенные расстояния диффузии | |
| Адверзивные геометрии диффузии (параллельные и встречные опухолевые микрососуды, диффузионная геометрия Крога или Хилла) | |
| Экстремальные продольные внутрисосудистые градиенты кислорода | |
| Шунтирование перфузии | |
| 2. Гипоксическая гипоксия | |
| Опухоль-ассоциированная анемия | |
| Терапия-индуцированная анемия | |
| Небольшие опухоли печени, кровоснабжаемые воротной веной | |
| HbCO формирование у часто курящих | |
| 3. Нарушение перфузии микрососудов | |
| Нарушение сил Старлинга вследствие высокого интерстициального жидкостного давления (трансмуральная связь) | |
| Компрессия микрососудов вследствие солиднофазного стресса, вызванного нежидкими компонентами | |
| Временное ограничение | Часы → недели (в экспериментальных условиях) |
| B. Острая гипоксия | |
| Синонимы | Преходящая, кратковременная, перфузия-ограниченная, циклическая, флуктуирующая, интермиттирующая, периодическая |
| Причины (патогенез) | 1. Временная остановка кровотока в микрососудах |
| Вследствие клеточных агрегатов и/или сгустков фибрина | |
| Ишемическая гипоксия вследствие сосудистой перестройки | |
| 2. Транзиторная гипоксемия | |
| Временный поток плазмы в микрососудах | |
| Колебания потока эритроцитов | |
| Временное ограничение | Минуты → 1 час (хорошо не определены; циклы спонтанной гипоксии демонстрируют пространственные и временные нарушения) |
Детекция опухолевой гипоксии
Оценка состояния опухолевой оксигенации при экспериментальных опухолях и в клинических условиях проводилась с использованием различных методик. До сих пор наиболее прямым и часто используемым методом описания оксигенации является полярографическое измерение парциального давления O2. С помощью этой инвазивной микротехнологии можно получить частотные распределения (гистограммы) измеренных внутриопухолевых значений pO2 с относительно высоким пространственным разрешением. Другие прямые процедуры включают волоконно-оптические O2 сенсоры и оксиметрию с использованием электронного парамагнитного резонанса (EPR). Последний метод является минимально инвазивным, требующим только применения парамагнитного материала.
Измерение внутрисосудистой сатурации оксигемоглобина (HbO2) является другим методом, позволяющим охарактеризовать статус оксигенации опухолей человека (уровень кислорода крови-зависимая магнитно-резонансная томография, BOLD-MRI). Однако он обеспечивает только информирование, ассоциированные с сосудистым компартментом, и, таким образом, ситуацию во внесосудистом пространстве можно только предполагать. Еще одним МРТ-базисным методом является динамическая контраст-усиленная (DCE)-MRI, которая обеспечивает лишь косвенной информацией о состоянии оксигенации, производную от кинетики обмена контрастного агента между сосудами и экстраваскулярным пространством.
Опухолевая оксигенация может быть измерена томографической визуализацией в клинических условиях после ингаляции радиоактивно меченого 15O-газа позитронно-эмиссионной томографией (PET). Однако, как и в случае с MRI, ограничения связаны с обеспечением количественных данных и довольно низким пространственным разрешением метода. Параметр, измеренный с помощью этих неинвазивных методов, нельзя прямо интерпретировать как pO2 значение или O2 концентрацию в опухоли.
Неинвазивные методы детекции опухолевой гипоксии включают связывание и задержку радиоактивно меченых биоредуктивных препаратов, таких как фтормизонидазол (меченый 18F и определяемый позитронно-эмиссионной томографией) и арабинозид йодоазомицина (меченый 123I и определяемый однофотонной эмиссионной компьютерной томографией, SPECT).
Несколько методов оценки опухолевой оксигенации требуют анализа образцов опухолевой биопсии. Используя иммуногистохимию с экзогенными маркерами гипоксии (например, пимонидазол), можно получить подробную информацию о гипоксии на клеточном уровне. Недостатки включают необходимость введения маркера гипоксии и возможные ошибки при отборе проб. Пригодность так называемых эндогенных маркеров гипоксии (например, HIF-1α, GLUT-1, CA IX) была поставлена под сомнение вследствие отсутствия корреляции с прямыми измерениями pO2 и множества факторов, влияющих на уровни экспрессии этих маркеров, помимо гипоксии.
Клиническая релевантность
Опухолевая гипоксия считается терапевтической проблемой, поскольку она делает солидные опухоли резистентными к рассеяному ионизирующему излучению (рентгеновскому и гамма-излучению), некоторым формам химиотерапии (например, циклофосфан, карбоплатин) и фотодинамической терапии. Уровни кислорода могут также влиять на ряд биологических параметров, которые, в свою очередь, могут заметно увеличивать злокачественный потенциал опухоли независимо от методов противоопухолевого лечения.
Динамическая гипоксия является типичной характеристикой локально распространенных солидных опухолей, ассоциированной со злокачественным прогрессированием, то есть увеличением вероятности рецидива, локорегионарного распространения и отдаленного метастазирования. Появляющиеся данные указывают на то, что эффект гипоксии на злокачественное прогрессирование опосредован серией гипоксия-индуцированных протеомных (<1% О2) и геномных изменений (<0,1% О2), приводящих к активированному ангиогенезу, анаэробному метаболизму, локальному инвазивному росту, метастазированию, потере апоптотического потенциала и другим процессам, которые позволяют опухолевым клеткам выживать или избегать кислород-дефицитной среды. Гипоксия-зависимые факторы включают HIF, NF-κB, AP-1, Sp1 и активацию ответа анфолдинга протеинов (UPR), что указывает на избыточность механизмов биологического ответа в злокачественных опухолях ниже 1% O2. Транскрипционный фактор гипоксия-индуцибельный фактор 1 (HIF-1) является ключевым регулятором адаптации опухолевых клеток к гипоксическому стрессу. Опухолевые клетки с протеомными и геномными изменениями, способствующими выживанию в условиях гипоксии, будут пролиферировать, тем самым еще больше усугубляя гипоксию. Мутагенез, генетическая нестабильность, отбор и размножение новых (и более агрессивных) клонов, которые со временем становятся доминантным типом опухолевых клеток, приводят к установлению порочного круга гипоксии и злокачественного прогрессирования (рис. 2). По наблюдениям, злокачественному прогрессированию способствуют повторяющиеся сложные циклы эпизодов гипоксии и реоксигенации, которые становятся ключевыми факторами патофизиома опухоли.
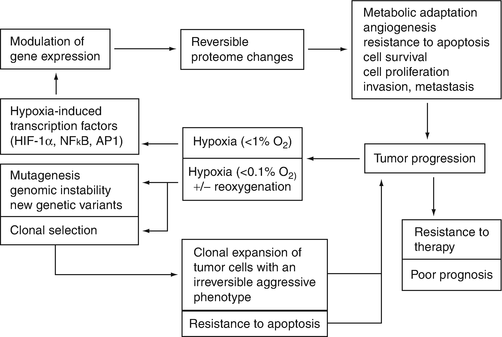
Фиг. 2. Схематическое изображение механизмов, вызывающих гипоксия-индуцированные протеомные и геномные изменения, приводящие к опухолевой агрессивности, злокачественному прогрессированию, резистентности к лечению и неблагоприятному прогнозу
Гипоксия-ассоциированная резистентность к радио- и химиотерапии является многофакторной. Помимо прямых эффектов (например, снижение фиксации ДНК повреждений) и гипоксия-индуцированных геномных и протеомных изменений, ключевую роль играют и косвенные эффекты. Например, гипоксия может вести к ингибированию клеточной пролиферации, тем самым делая клетки резистентными к определенным клеточный цикл-специфическим химиотерапевтическим препаратам.
Опухолевая оксигенация как прогностический параметр
Клинические исследования проведены более чем у 700 больных локально распространенным раком шейки матки, плоскоклеточным раком головы и шеи, саркомами мягких тканей. эти исследования показали, что опухолевая оксигенация перед лечением является мощным прогностическим фактором. Опухолевая гипоксия отрицательно влияет на локорегиональный контроль, безрецидивную выживаемость и общую выживаемость (рак шейки матки и опухоли головы и шеи). Этот эффект не зависит от других известных прогностических переменных. Гипоксия также снижает безрецидивную и общую выживаемость в саркоме мягких тканей.
Модуляция опухолевой оксигенации
Манипуляции статусом опухолевой оксигенации для терапевтического успеха проводятся уже много лет. Был рассмотрен ряд стратегий улучшения опухолевой оксигенации и повышения ее однородности. К ним относятся повышение доступности O2 и/или снижение степени клеточного дыхания. Первое может быть достигнуто либо за счет увеличения содержания О2 в опухолевых микрососудах, либо за счет улучшения кровотока в опухоли. Уменьшение скорости потребления О2 позволило бы обеспечить дальнейшую диффузию О2 из кровеносных сосудов в отдаленные клеточные слои для удовлетворения потребностей этих опухолевых клеток вдали от «источника О2», т. е. из микрососудов, перфузированных эритроцитами.
Принимая во внимание накопившиеся к настоящему времени данные о стратегиях улучшения опухолевой оксигенации, маловероятно, что существует единственное решение для преодоления опухолевой гипоксии. Более рациональным подходом может быть комбинирование ряда этих средств, поскольку многие факторы, способствующие опухолевой гипоксии, действуют параллельно, а не последовательно друг с другом.
Литература:
Höckel M, Vaupel P (2001) Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. J Natl Cancer Inst 93:266–276
Mayer A, Wree A, Höckel M, Leo C, Pilch H, Vaupel P (2004) Lack of correlation between expression of HIF-1α protein and oxygenation status in identical tissue areas of squamous cell carcinomas of the uterine cervix. Cancer Res 64:5876–5881
Semenza GL (2000) Hypoxia, clonal selection, and the role of HIF-1 in tumor progression. Crit Rev Biochem Mol Biol 35:71–103
Vaupel P (2004) The role of hypoxia-induced factors in tumor progression. Oncologist 9(Suppl 5):10–17
Vaupel P (2009a) Pathophysiology of solid tumors. In: Molls M, Vaupel P, Nieder C, Anscher MS (eds) The impact of tumor biology on cancer treatment and multidisciplinary strategies. Springer, Berlin/Heidelberg/New York, pp 51–926
Vaupel P (2009b) Physiological mechanisms of treatment resistance. In: Molls M, Vaupel P, Nieder C, Anscher MS (eds) The impact of tumor biology on cancer treatment and multidisciplinary strategies. Springer, Berlin/Heidelberg/New York, pp 273–290
Vaupel P, Kelleher DK (eds) (1999) Tumor hypoxia. Wissenschaftl. Verlagsges, Stuttgart
Vaupel P, Mayer A (2014) Hypoxia in tumors: pathogenesis-related classification, characterization of hypoxia subtypes, and associated biological and clinical implications. Adv Exp Med Biol 812:19–24
Vaupel P, Mayer A, Höckel M (2004) Tumor hypoxia and malignant progression. Methods Enzymol 381:335–354
Vaupel P, Höckel M, Mayer A (2007) Detection and characterization of tumor hypoxia using pO2 histography. Antioxid Redox Signal 9:1221–1235
Vaupel P, Mayer A (2007) Hypoxia in cancer: significance and impact on clinical outcome. Cancer Metastasis Rev 26:225–239.