Почти каждая клетка в нашем организме высвобождает внеклеточные везикулы (EV), которые представляют собой наноразмерные липидные двухслойные мембранные везикулы, которые высвобождаются во внеклеточную среду. EV сегодня классифицируются как экзосомы, микровезикулы и апоптотические тельца в зависимости от их размера, биогенеза, молекулярного состава и функций. Они найдены в различных жидкостях организма, включая циркулирующую кровь, грудное молоко, желчь, слюну, выделения из носа, сперму, спинномозговую жидкость, лимфу, слезы, мочу и амниотическую жидкость (Фиг. 1).
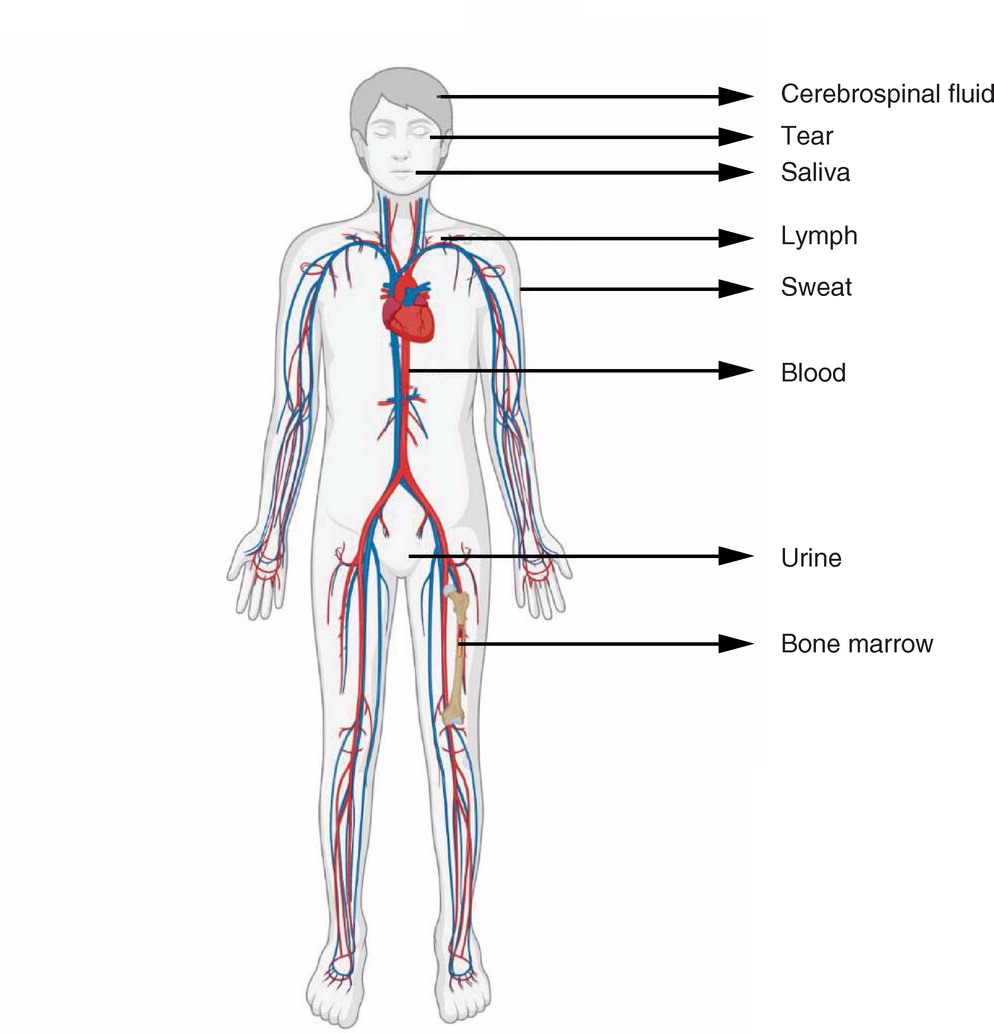
Фиг. 1. Различные биологические жидкости в организме человека.
Экзосомы являются наименьшими по размеру EV, имеют чашеобразную морфологию при наблюдении под криоэлектронной микроскопией и более однородны по форме по сравнению с другими EV (Фиг. 2). Экзосомы были открыты Pan и Johnstone в 1983 г. в процессе созревания эритроцитов из ретикулоцитов овцы [1]. Экзосомы представляют собой биологические наночастицы, формируемые почти всеми нормальными и больными клеточными типами, и найдены во всех жидкостях организма, а также в выращенных in vitro клеточных линиях со средним диаметром от 30 до 100 нм [2].
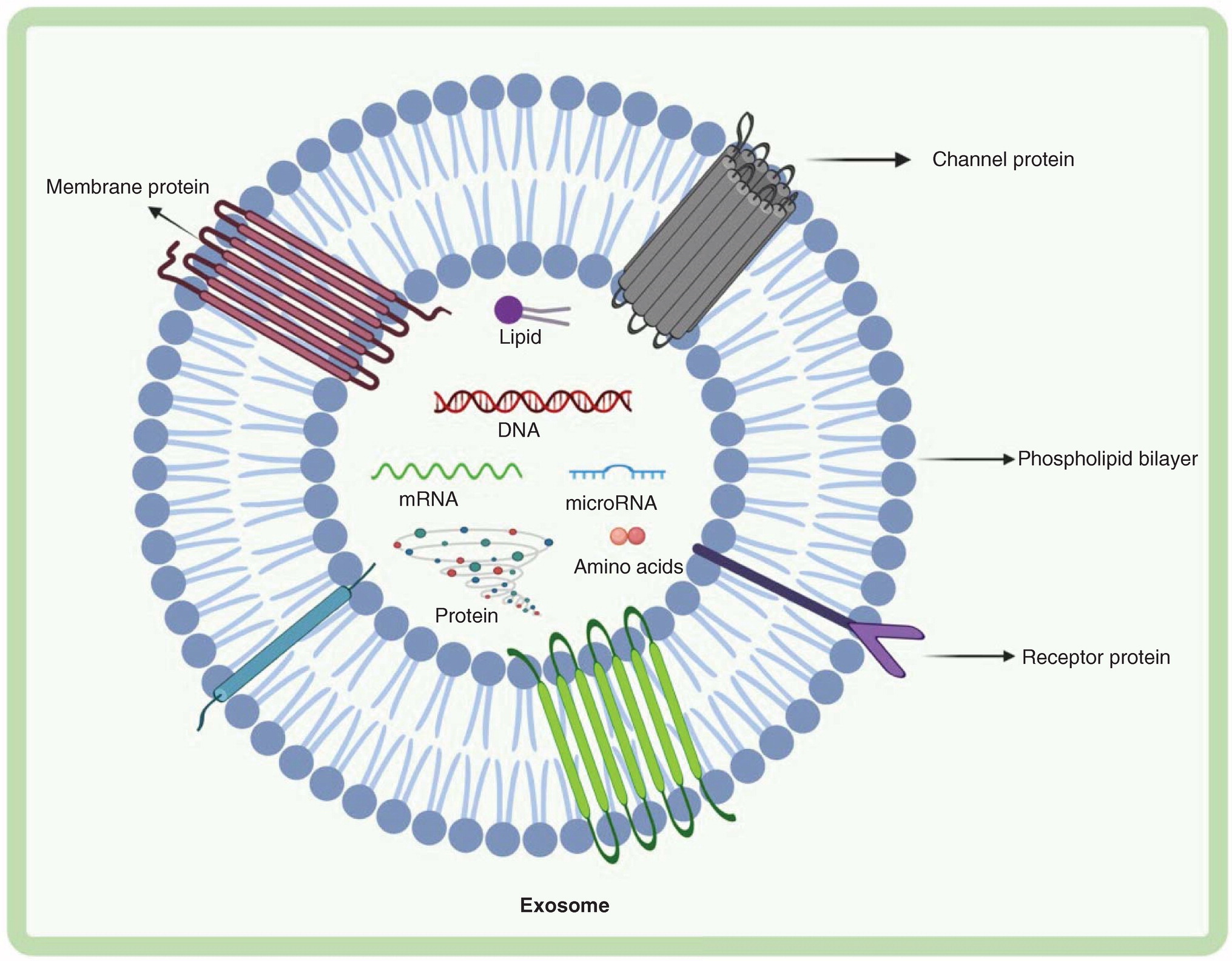
Фиг. 2. Структура экзосомы. Экзосомы содержат ДНК, РНК, протеины, липиды и метаболиты. Экзосомы состоят из различных протеинов: трансмембранных протеинов, таких как тетраспанины, антиген-презентирующие молекулы, гликопротеины и адгезивные молекулы; протеинов в просвете экзосомы, такие как протеины теплового шока (Hsp), цитоскелетные протеины, ESCRT компоненты, протеины мембранного транспорта, протеины слияния (fusion), факторы роста и цитокины. Экзосомы также содержат множество липидов, таких как холестерин, церамиды, сфингомиелин, фосфатидилинозитол (PI), фосфатидилсерин (PS), фосфатидилхолин (PC), фосфатидилэтаноламин (PE) и ганглиозиды (GM), а также нуклеиновые кислоты, такие как ДНК и не-кодирующие РНК в их просвете. ESCRT: endosomal sorting complex required for transport; FasL: Fas лиганд; Hsc: heat shock cognate; TfR: трансферриновый рецептор; TGF: трансформирующий фактор роста; TNF: фактор некроза опухоли; TRAIL: TNF-ассоциированные apoptosis-inducing ligand; TSG: tumor suspectibility gene.
Экзосомы формируются эндоцитарным путем (эндоцитоз), который включает отпочкование (баддинг) внутрипросветных везикул вовнутрь от плазматической мембраны, и высвобождаются во внеклеточное пространство (экзоцитоз) после слияния поздних эндосом или мультивезикулярных телец с плазматической мембраной (Фиг. 3) [3–9]. Мультивезикулярное тельце может или деградировать путем слияния с лизосомами или аутофагосомами, или может сливаться с плазматической мембраной и высвобождать экзосомы [10,11]. Высвобождаемые экзосомы могут поглощаться клетками-мишенями тремя возможными путями: слиянием с клеточной мембраной, эндоцитарной абсорбцией и взаимодействием с лигандом или рецептором [12].
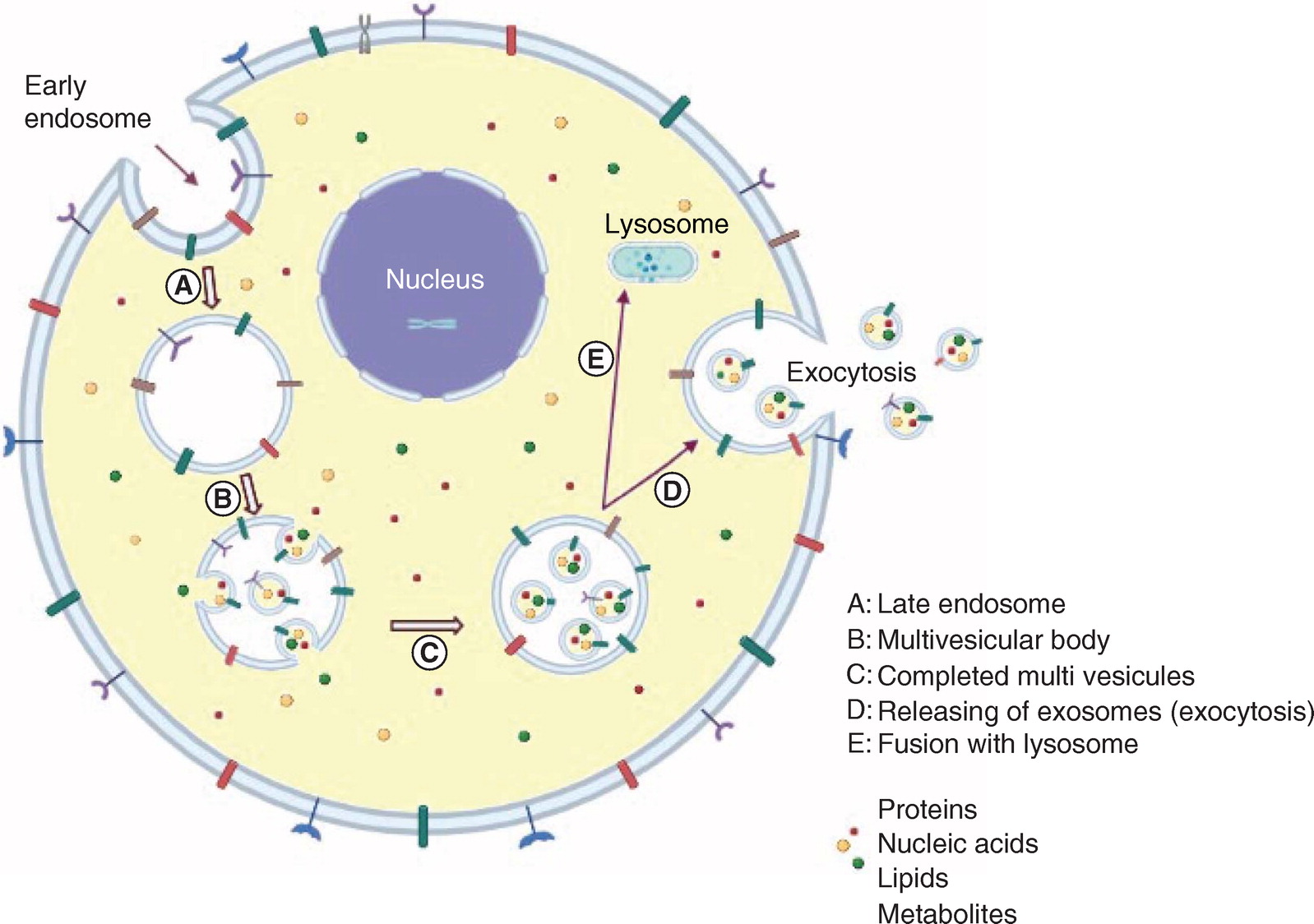
Фиг. 3. Биогенез экзосом и путь их высвобождения. (A) Экзосома происходит из ранних плазматическая мембрана-формируемых эндосом (эндоцитоз). (B) Далее, ранние эндосомы трансформируются в поздние эндосомы. (C) После этого они формируют ранние мультивезикулярные тела. (D) Мультивезикулярные тела поздней стадии. (E) Для высвобождения экзосом поздние мультивезикулярные тельца могут или соединяться с аутофагосомами и следовать по пути деградации через лизосомы, или они могут сливаться с плазматической мембраной благодаря микротрубочкам и цитоскелетной сети и высвобождаться путем отпочкования от цитоплазматической мембраны (экзоцитоз)
Экзосомы в настоящее время являются популярной темой в медицине, с большими перспективами в плане лечения заболеваний агентами, полученными из аномальных клеток. Экзосомальное содержимое, включая фрагменты ДНК (как из ядра, так и из митохондрий), различные виды РНК (кодирующие и некодирующие РНК), протеины цитозоля и клеточной поверхности и небольшие метаболиты, были показаны во многих исследованиях. Некодирующие miRNA являются одним из наиболее распространенных грузов экзосом. Эти биоактивные молекулы переносятся от донорских клеток к таргетным клеткам с помощью экзосомной транспортной системы, вызывая перепрограммирование клеток-реципиентов. Экзосомы могут быть выделены из жидкостей пациента и введены тому же пациенту с новым грузом для таргетной терапии опухолей после модификации [13-15]. Терапевтические грузы, такие как miRNA или лекарственные препараты, могут быть загружены в нативные экзосомы, изолированные и очищенные из клеточной среды, и доставлены путем свободной диффузии, инкубации, обработки ультразвуком, циклами замораживания-оттаивания или электропорации [16].
Методы выделения экзосом постоянно совершенствуются и современные биомаркеры могут распознавать только субсет экзосом с определенным содержимым [10,17–20]. В результате внедрения новых технологий некоторые выводы необходимо будет пересматривать. Действие экзосом на клетки-реципиенты может отличаться вследствие разнообразной экспрессии рецепторов на клеточной поверхности, что приводит к тому, что один набор экзосом обеспечивает выживание клеток, другой набор способствует гибели клеток, а третий набор стимулирует иммуномодуляцию, среди прочего, в различных таргетных клеточных типах.
Экзосомы влияют на широкий спектр физиологических процессов, включая иммунные ответы [21,22], поддержание стволовых клеток [23], репарацию тканей [24,25], ЦНС коммуникацию [26] и патологические процессы в сердечно-сосудистых заболеваниях [27, 28], нейродегенерации [29], туморогенез [30] и воспаление [31]. Исследователи все больше интересуются потенциалом этих маленьких чудо-везикул для помощи в трансфере генов, диагностике заболеваний, клеточной коммуникации, доставке лекарственных препаратов и биомаркер-драйверной терапии [32]. Создание искусственных экзосом — это постоянно растущая область исследований, которая способствует оценке различных терапевтических грузов, повышению селективности мишеней, минимизации аккумуляции лекарств в нетаргентых тканях/органах и оптимизации производства. Клинические исследования по их использованию в качестве биомаркеров для диагностики, тяжести заболевания и терапевтического ответа, а также инженерные применения в качестве векторов доставки терапевтических грузов в настоящее время создаются и быстро транслируются в клинических исследованиях. Эти подходы подчеркивают важность улучшенной экзосома-опосредованной клеточной коммуникации [33–35].
Экзосомальные miRNA играют важную роль в патофизиологии многих, если не всех, заболеваний человека, включая рак, нейродегенеративные и сердечно-сосудистые заболевания и заживление ран [36]. miRNA преимущественно локализуются в цитозоле, но они также упакованы в качестве груза в экзосомах, где защищены от деградации RNase, присутствующей в различных биологических жидкостях [37]. miRNA, упакованные в экзосомы, действуют как посттранскрипционные генные регуляторы, связываясь с таргетными mRNA, блокируя трансляцию mRNA или разрушая mRNA и, таким образом, подавляя генную экспрессию. В зависимости от таргетной mRNA, miRNA могут действовать как опухолевые супрессоры или онко-miRNA, играя ключевую роль в опухолевом росте, прогрессировании, резистентности к терапии и метастазировании. В опухолевых клетках экспрессия miRNA может нарушаться, что приводит к сверхэкспрессии онкогенной miRNA и недостаточной экспрессии опухоль-супрессорной mRNA. Многие онкогенные mRNA играют ключевую роль в клеточной пролиферации, метастазировании и активации онкогенных транскрипционных факторов, которые гиперэкспрессируются в различных раковых клетках.
Они обладают большим потенциалом для использования в терапевтических целях в качестве альтернативы транскрипционным факторам для репрограммирования соматических клеток благодаря их небольшому размеру, ткань-специфической экспрессии, способности безопасно доставляться в клетки, регуляции большого числа генов, взаимосвязанных сетей и путей и, наконец, их участие в транзитах клеточных судеб [38]. В свете информации, полученной на сегодняшний день, до десяти отличительных признаков экзосом можно классифицировать по их функциям (рис. 4):
- Регуляция генной экспрессии
- Внутриклеточный сигналинг и клеточно-клеточная коммуникация
- Репрограммирование таргетной клетки
- Выживание и пролиферация
- Клеточное дифференцирование и неоплазия
- Модуляция иммунной системы
- Индукция ангиогенеза
- Активация инвазии и метастазирования
- Диагностические и прогностические биомаркеры
- Средство доставки (лекарства, вакцины, протеины и нуклеиновые кислоты).
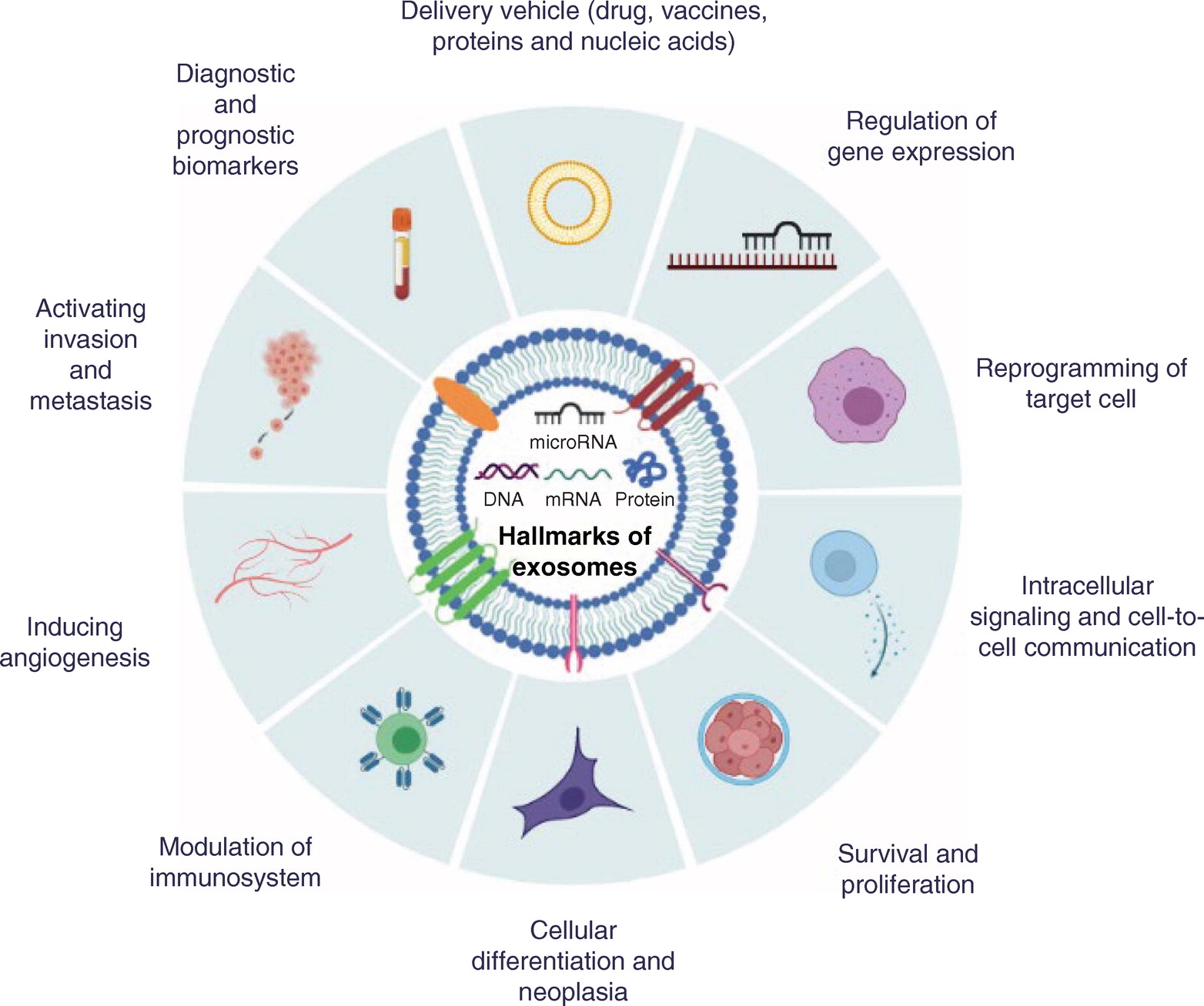
Фиг. 4. Отличительные признаки экзосом
Регуляция генной экспрессии
Эндогенные mRNA прямо влияют на генную экспрессию в ядре на уровне транскрипции и посттранскрипционно в цитоплазме. Экзосомальная mRNA может действовать на экспрессию компонентов эпигенетического аппарата таргетируя эпигенетика-ассоциированные ферменты, такие как ДНК-метилтрансферазы (DNMT), гистоновые деацетилазы, гистоновые метилтрансферазы и ten–eleven translocation ферменты [39]. В последние годы влияние miRNA на эпигенетическую экспрессию, такое как метилирование и деметилирование ДНК, модификация РНК и модификация гистонов, стало более широко признано. miRNA может действовать на профиль метилирования генома, регулируя экспрессию ДНК метилирование-ассоциированных ферментов.
miR-29b была первой обнаруженной эпигенетической miRNA. Он вызывает глобальное гипометилирование ДНК, супрессируя DNMT экспрессию или прямым таргетингом 3′-UTR областей DNMT3A и DNMT3B, или опосредованным таргетингом Sp1 (specificity protein 1), трансактиватора DNMT1 гена в случае DNMT1 [40–42]. В раке легкого опухоль-супрессорные гены, например, fragile histidine triad enzyme и WW домен-содержащая оксидоредуктаза, которые были эпигенетически репрессированы гиперметилированием промотора, реэкспрессировались в результате деметилирования CpG островков промотора после повторного введения miR-29b [40,43]. miRNA также может регулировать модификацию гистонов дополнительно к ДНК-метилтрансферазам. Модификации гистонов H3K4me1, H3K27me3, H3K27ac, H3K9ac, H3K4me3 и H2AZ регулируются miRNA во время сперматогенеза человека [39,44].
miRNA также играют ключевую роль в регуляции клеточного цикла эмбриональных стволовых клеток (ESC). miR-290-295, miR-302, miR-17-92, miR-106b-25, miR-106a-363 кластеры и let-7 семейство являются наиболее часто экспрессируемыми miRNA в ESC, составляя примерно 70% от общего количества miRNA молекул [45–48]. Эти miRNA способствуют G1/S транзиту, снижая экспрессию Rb протеинов в ESC [46].
Внутриклеточный сигналинг и межклеточная коммуникация
Экзосомы транспортируют инкапсулированные протеины и генетическую информацию к таргетным клеткам, выступая в роли мессенджеров информации от одной клетки к другой. Экзосомы действуют на клетки-реципиенты, влияя на огромное количество генов и внутриклеточных сигнальных путей, что приводит к изменениям функции или фенотипа клеток-хозяина. Они опосредуют транспорт различных сигнальных молекул от аномальных клеток к нормальным клеткам, который может регулироваться отрицательно. Экзосомы играют ключевую роль в межклеточных коммуникациях как между близлежащими, так и отдаленными клетками, вызывая физиологические изменения в клетках-реципиентах путем переноса своего груза, и они связаны с рядом патологий, включая рак, неврологические расстройства, сердечно-сосудистые и аутоиммунные заболевания [49,50]. Экзосомы представляют большой интерес для молекулярных биологов, потому что они продуцируются уникальным внутриклеточным регулирующим процессом, который определяет их состав и, потенциально, их функции после секреции во внеклеточную среду [10,51-53].
Перепрограммирование таргетной клетки
Перепрограммирование клеток — процесс, который трансформирует дифференцированную соматическую клетку в форму плюрипотентной стволовой клетки (PSC) или, в некоторых случаях, генерирует новую единицу при определенных обстоятельствах. Эффективность перепрограммирования индуцированных PSC (iPSC) регулируется miRNA. Гиперэкспрессия miR-290 или miR-302 семейств, например, повышает эффективность перепрограммирования [54]. Удивительно, но miRNA обладают способностью прямо трансформировать соматические клетки в iPSC. Например, клетки рака кожи человека перепрограммируются в плюрипотентное состояние с использованием miR-302 кластера [55]. Также прямая трансфекция зрелых miR-200c, miR-302 и miR-369 в соматические клетки мыши и человека также может трансформировать их в плюрипотентные статусы [56]. miRNA из miR-30/let-7 семейства, экспрессия которых гипорегулируется, и miRNA из miR-17, miR-19, miR-290 и miR-8 семейств, экспрессия которых гиперрегулируется, играют существенную роль в активации и поддержании плюрипотентности [57]. Тремя фазами процесса miRNA-опосредованного перепрограммирования стволовых клеток являются инициация, созревание и стабилизация [58]. miR-138 и miR-302/367, например, промотируют генерацию iPSC, а miR-34a и miR-195 ингибируют ее. miR-21, miR-1, miR-155, miR-184, miR-199a, miR-199b, miR-211 и miR-449 индуцируют дифференцирование, а miR-495 ингибирует его [59].
Перепрограммирование опухолевой микросреды (TME) является критической для развития и установления злокачественного фенотипа [60]. Опухоль-дериватные экзосомы доставляют в клетки-реципиенты опухоль-промотирующие субстанции, вызывая активацию аномальных сигнальных путей и возникновение мутаций, индуцируя необратимые изменения в таргетных клетках. Экзосомальная miR-93 способствует пролиферации и инвазии гепатоцеллюлярной карциномы, и гиперэкспрессия экзосомальной миР-93 предсказывает плохой прогноз у пациентов с гепатоцеллюлярной карциномой [60,61].
Выживание и пролиферация
Рост, развитие, размножение и генетика человека основаны на пролиферации клеток. Изменения в экспрессии или активности клеточный цикл-ассоциированных протеинов также важны для развития опухоли [62,63]. Экзосомы, продуцируемые опухолевыми клетками, стимулируют рост опухоли прямыми активирующими сигнальными механизмами, таких как фосфорилированная фосфатидилинозитол-3-киназа/протеинкиназа B (P13K/AKT) или митоген-активируемая протеинкиназа/внеклеточный сигнал-регулируемая киназа (MAPK/ERK), которые отвечают за поддержание опухолевой пролиферации [64–68]. Экзосома-опосредованная активация P13K/AKT или MAPK/ERK путей индуцирует клеточную пролиферацию в клетках рака желудка [66]. Экзосомальный протеин кластера дифференцирования 97 (CD97) вовлечен в MAPK путь-опосредованную пролиферацию [67]. Экзосомы, полученные из клеток рака мочевого пузыря и плоскоклеточной карциномы полости рта, также показали, что активированные PI3K/AKT и MAPK/ERK пути стимулируют клеточную пролиферацию [68,69]. Экзосомы, генерируемые из тромбоцитов, переносят гликопротеин IIb–IIIa (CD41) на поверхность раковых клеток легкого, индуцируя экспрессию G1/S-специфичных циклинов D2 в раковых клетках легкого с целью промотировать фосфорилирование MAPKp4244; также экзосомы стимулировали пролиферацию раковых клеток легкого [70].
Опухолевые клетки-дериватные экзосомы могут модифицировать микросреду, облегчая инвазию и диссеминацию, в дополнение к их влиянию на пролиферацию клеток. В частности, экзосомы, полученные из раковых клеток предстательной железы, трансформируют фибробласты в активированные фибробласты или миофибробласты трансфером TGF-β во внеклеточную среду [64,71,72]. Фибробласты многочисленны в опухолевых тканях, и их активная форма хорошо известна своей функцией в опухолевом прогрессировании благодаря высвобождению факторов роста [51,73]. Аналогичным образом, экзосома-опосредованный трансфер TGF-β индуцирует дифференцирование и активацию фибробластов в раке мочевого пузыря [74].
Клеточное дифференцирование и неоплазия
Клеточное дифференцирование, неоплазия, развитие и метастазирование опухоли, паранеопластические расстройства и терапевтическая резистентность — все зависит от экзосом. Участие экзосом в прогрессировании рака является динамичным и определяется типом рака, генетикой и стадией заболевания [10]. Путем трансфера своего miRNA груза экзосомы, полученные из раковых клеток молочной и предстательной желез, способствуют развитию неоплазии. В экзосомах из раковых клеток предстательной железы miR-125b, miR-130 и miR-155, а также Harvey-Ras и Kirsten-Ras mRNA играют ключевую роль в неопластическом перепрограммировании и развитии опухолей из адипозных стволовых клеток [10,75, 76].
miRNA и дифференцирование стволовых клеток
Стволовые клетки имеют отличительные профили экспрессии miRNA, которые влияют на их судьбу [77]. Эти профили экспрессии могут использоваться для окончательного дифференцирования соматических клеток из стволовых клеток для лечения различных заболеваний, включая инфаркт миокарда, неврологические заболевания, заболевания мышц и болезни крови. С одной стороны, miR-499, таргетируя Sox6, повышает кардиоваскулярное дифференцирование кардиомиоцитных прогениторных клеток человека [78]; с другой стороны, miRNA регулируют кардиоваскулярное дифференцирование ESC и iPSC. Через PTEN (phosphatase and tensin homology deleted on chromosome ten)/Akt путь, miR-1 повышает кардиальное дифференцирование ESC и супрессирует апоптоз кардиомиоцитов в инфарктном сердце [79]. miR-1 также активирует Kruppel-like factor 4 в ретиноидная кислота-индуцированных ESC, что стимулирует дифференцирование гладкомышечных клеток [80]. miR-199b регулирует STAT3/VEGF-сигналинг, который промотирует EC дифференцирование в iPSC мыши [81].
Модуляция иммунной системы
Экзосома-дериватные miRNA действуют как мост между раковыми и иммунными клетками, позволяя им общаться друг с другом. Экзосомы могут как активировать развитие опухоли, генерируя противоопухолевые иммунные ответы, так и репрессировать опухолевый рост, вызывая иммуносупрессию и уклонение от иммунного надзора в канцере. Иммуностимулирующие эффекты экзосом в основном зависят от антигенной презентации, которую они несут, тогда как их иммуносупрессивные эффекты преимущественно зависят от содержащихся в них лигандов, протеинов и miRNA, которые ингибируют противоопухолевую активность цитотоксических Т-лимфоцитов или повышают число иммуносупрессивных клеток. Способность экзосом экспрессировать опухоль-ассоциированные антигены, МНС и определенные хемокины, а также индуцировать иммунные ответы Т-хелперов открывает возможность их использования в качестве противоопухолевых вакцин [90]. Способность опухолевых клеток уклоняться от иммунного надзора определена как фундаментальный аспект метастазирования и связана с терапевтической резистентностью [60]. Экзосомы связаны с дисфункцией как врожденной, так и адаптивной систем.
Опухоль-дериватные экзосомы из раковых клеток поджелудочной железы снижают экспрессию двух ключевых цитокинов, фактора некроза опухоли и интерферона, во врожденных естественных киллерных клетках, а также цитотоксичность естественных киллерных клеток в отношении раковых стволовых клеток, которые ответственны за метастатический процесс [60,91]. Т-клетка-опосредованные противоопухолевые иммунитеты также могут усиливаться вакцинацией опухолевый антиген-загруженными дендритная клетка-дериватными экзосомами [12,64]. Многие опухолевая клетка-дериватные экзосомы несут молекулы из родительских опухолевых клеток, которые могут изменять активацию иммунных клеток, клеточное развитие и противораковые действия прямо или опосредованно [64,92–94]. Как результат, раковые антигены, обнаруженные в экзосомах, исследуются в качестве противораковых вакцин в иммунотерапии [95,96].
Экзосомы влияют на иммуносупрессию, опухолевый рост и ответ на противоопухолевую терапию, модулируя основные функциональные аспекты лимфоидно-миелоидных компонентов TME [97]. Экзосомы можно использовать в терапевтических целях в качестве мощного оружия для активации противоопухолевого иммунитета, что может вести к появлению новых вариантов лечения рака. Экзосомы до сих пор использовались при создании терапий, нацеленных на Т-лимфоциты и антиген-презентирующие клеточно-опосредованные иммунитеты [97].
Индуцирование ангиогенеза
Ангиогенез (генерация новых кровеносных сосудов) является естественным процессом, при котором уже существующие сосуды используются для создания новых кровеносных сосудов. Это часто происходит у организмов на протяжении их роста и развития, а также в ответ на любые травмы [64,98]. Этот процесс, тем не менее, критический для прогрессирования рака, поскольку опухолевый рост требует быстрого формирования сосудистой сети для обеспечения доступа к питанию, кислороду и выведению отходов [64]. Ангиогенез необходим для развития и метастазирования злокачественных опухолей, поскольку новые кровеносные сосуды обеспечивают большим кислородом и нутриентами, одновременно удаляя продукты жизнедеятельности [99]. Ангиогенез определяют как формирование новых тонких кровеносных сосудов из существующих кровеносных сосудов, а также сложную активность эндотелиальных клеток, все из которых связаны с повышенной проницаемостью сосудов, промотирующее опухолевый рост и метастазирование.
Экзосомы играют важную роль в ангиогенезе, транспортируя miRNA, mRNA и протеины [10, 100, 101]. Например, экзосомы, полученные из клеток лейкемии, сверхэкспрессируют miR-92a (miRNA, принадлежащая к кластеру mir-17-92), когда они достигают эндотелиальных клеток, что приводит к увеличению подвижности и формированию трубок [100]. Экзосомы могут транспортировать Delta-like 4, мембраносвязанный Notch лиганд, который играет ключевую роль в формировании сосудов и ангиогенезе, через трехмерный коллагеновый матрикс и в отдаленных клетках [101].
Экзосома-индуцированная неконтролируемая пролиферация клеток приводит к недостатку поступления кислорода и нутриентов в TME, вызывая гипоксию, которая способствует эпителиально-мезенхимальному транзиту и более инвазивному фенотипу [60,102,103]. Для поддержания своей микросреды и метастазирования развивающейся опухоли требуется новая сосудистая сеть для достаточного снабжения кислородом и нутриентами [60,104]. Экзосомы также связаны с ангиогенным TME и перестройкой внеклеточного матрикса, что является критической стадией опухолевого роста и метастатической диссеминации. Например, экспрессия эндотелиального плотного соединения zonular occludens 1 (ZO-1) супрессируется раковая клетка молочной железы-дериватной экзосомальной miR-105, результируя в повышение метастазирования за счет снижения интеграции кровеносных сосудов и увеличения сосудистой проницаемости [10,105].
Экзосомальная miR-155-5p, полученная из меланомы, может индуцировать фибробласты экспрессировать проангиогенные факторы VEGFa, FGF2 и другие, что дает новые стратегии для супрессии пролиферации меланомы через повышение цитокинового сигналинга. Раковая клетка молочной железы-дериватные экзосомальные онкогенные miRNA, такие как miR-105, супрессируют экспрессию ZO-1 эндотелиальных плотных соединений, способствуя увеличению метастазирования за счет нарушения интеграции кровеносных сосудов и повышения сосудистой проницаемости, участвуют в ангиогенной и внеклеточного матрикса перестройке TME. [10,106].
miRNA, найденная в экзосоме, такая как miR-9, miR-21, miR-23a, miR-29b, miR-92a, miR-103, miR-105, miR-126, miR-132, miR-135b, miR-155, miR-210, miR-221 и цитокины (интерлейкины: IL-6, IL-8 и IL-10, TNF-α, TGF-β, FGF2 и VEGF) оказались проангиогенными факторами, способствующими неоваскуляризации и метастазы [13,105–111]. Экзосомальная miR-9, например, продуцируется опухолевыми клетками и стимулирует путь Janus kinase/STAT супрессором цитокинового сигналинга 5 со стимуляцией опухолевого ангиогенеза [112].
Экзосомальная onco-miR-21 может активировать STAT3 пути в клетках-реципиентах, что приводит к повышению уровня клеточного VEGF рецептора, показывая, что miR-21 необходима для ангиогенеза. Гиперэкспрессия onco-miR-21 оказывает стимулирующее действие на антиапоптотический протеин Bcl-2 и опухоль-супрессорный протеин p53, а ее повышенная концентрация положительно связана с метастазированием и плохим прогнозом у больных раком молочной железы и легких [113].
Активация инвазии и метастазирования
Метастазирование — системное заболевание, возникающее полностью в результате взаимодействия злокачественной опухоли как с локальной, так и с отдаленной микросредами, что приводит к вторичному злокачественному развитию [60,114]. Наиболее распространенной причиной рак-ассоциированных смертей являются метастазы, на долю которых приходится более 90% всех рак-ассоциированных смертей [49,115]. Это сложный процесс, в котором раковые клетки диссеминируют по всему организму из первичной злокачественной опухоли в другие органы, формируя вторичные опухоли в новых тканевых сайтах. Экзосомы, дериваты опухолевых клеток, играют критическую роль в патофизиологии опухолевых метастазов, используя опухолевые сигнальные пути, такие как caveolin-1, HIF-1α, miR-21, miR-105, miR-148b, miR-210, β-catenin и онкогенные киназы (например, мутантные EGFR, RAS и MAP киназы) [49, 116–120].
Опухоль-дериватные экзосомы повышают метастазирование в отдаленные органы, а также модифицируют локальную TME для индукции канцерной пролиферации [119–121]. Опухолевое метастазирование представляет собой многошаговый процесс, который включает открепление от первичной опухоли, инвазию, движение через базальную мембрану, диффузию в кровоток и, в конечном итоге, адаптацию и колонизацию во вторичных органах [122,123]. Экзосома-опосредованные стратегии созданы раковыми клетками для воздействия на различные фазы метастатического процесса. Например, клеточные линии трижды негативного рака молочной железы (MDA-MB-231) гиперэкспрессируют miR-10b, и экзосомы, продуцируемые этими клетками, могут переносить miR-10b в незлокачественную линию эпителиальных клеток молочной железы человека, индуцируя инвазию [124].
Экзосомы, дериваты эпителиальных раковых клеток яичников, промотируют инвазию рака яичников перенося CD44 в перитонеальные мезотелиальные клетки человека [124]. miR-105 из метастатических MDA-MB-231 экзосом также может таргетировать ZO-1 протеин плотных контактов, разрушая барьеры эндотелиальных клеток, вызывая сосудистую проницаемость и способствуя метастазированию в моделях in vivo [125]. Избыточная экспрессия опухоль-дериватной экзосомальной miR-3157-3p промотирует ангиогенез, повышает сосудистую проницаемость и опосредует метастазирование гипорегулированием Kruppel-like factor 2 и тканевого ингибитора металлопротеиназы 2 в немелкоклеточном раке легкого у мышей [126].
Раковые клетки могут влиять на микросреду отдаленного органа после инвазии и интравазии, чтобы позволить опухолевым клеткам выжить и колонизировать до момента их прибытия [127]. Экзосомы из раковых клеток обладают способностью инициировать такой процесс [127–130]. Было показано, что экзосомы, дериваты протоковой аденокарциномы поджелудочной железы, индуцируют формирование предметастатической ниши в печени, а наивные мыши, получавшие экзосомы протоковой аденокарциномы поджелудочной железы, имели повышенный метастатический груз для печени [128]. Также экзосомы меланомы модифицируют отдаленные лимфатические узлы, способствуя формированию предметастатической ниши [130]. Экзосомы из меланомных клеток, обнаруженные в сигнальных лимфатических узлах, влияют на паттерн распределения свободных меланомных клеток в лимфатических узлах и промотируют клеточную миграцию в экзосома-обогащенные сайты.
Диагностические и прогностические биомаркеры
Экзосомная биология в заболеваниях по-прежнему находится в стадии развития, но количество исследований, посвященных их применению в диагностике и лечении различных заболеваний, резко возросло. Здесь используется сложное содержимое экзосом, что позволяет воспользоваться мультикомпонентным диагностическим окном для выявления заболеваний и мониторинга прогноза [10]. В нескольких исследованиях было показано, что экзосомы являются потенциальными кандидатами для использования в качестве диагностических и прогностических биомаркеров различных заболеваний, включая рак. Экзосомы содержат различные miRNA или кластеры miRNA, которые можно применять для диагностики или прогнозирования рака [10]. Из-за их отличительной экспрессии между раковыми и нормальными клетками онкогенные и опухоль-супрессорные miRNA в экзосомах могут иметь высокую диагностическую ценность, потенциально улучшая их полезность в ранней диагностике [131].
Глиобластомы, колоректальный рак, рак толстого кишечника, печени, молочной железы, яичников и пищевода связаны с повышенным уровнем циркулирующей экзосомальной miR-21, тогда как рак мочевого пузыря и предстательной железы связан с повышенным уровнем miR-21 моча-дериватных экзосом [10, 132]. miR-155, кластер miR-17–92 и miR-1246 являются другими экзосомальными онкогенными miRNA, связанными с различными видами рака [58, 133–135]. Активация этих miRNA наблюдалась в раке головного мозга, поджелудочной железы, толстого кишечника, печени, молочной железы, предстательной железы и пищевода, а также в лимфоме и лейкемии [10]. Опухоль-супрессорные miRNA, включая miR-634, miR-146a и miR-34a, ассоциированы с раком печени, молочной железы, толстого кишечника, поджелудочной железы и гематобластозами [131]. Внутривенное введение miR-634 вызывает гибель клеток и значительно снижает рост ксенотрансплантатных опухолей рака поджелудочной железы у мышей [136]. Этот результат свидетельствует о том, что доставка miR-634 потенциально может быть использована для лечения рака.
Экзосомальные miRNA биомаркеры постоянно появляются в связи с диагностикой и прогнозированием рака, и комбинация нескольких miRNA может повышать диагностическую и прогностическую ценность экзосомальных miRNA (Таблица 1) [62, 132, 137–144].
Таблица 1. Клиническое использование опухоль-дериватных экзосом в качестве диагностических или прогностических биомаркеров (для реф см.)
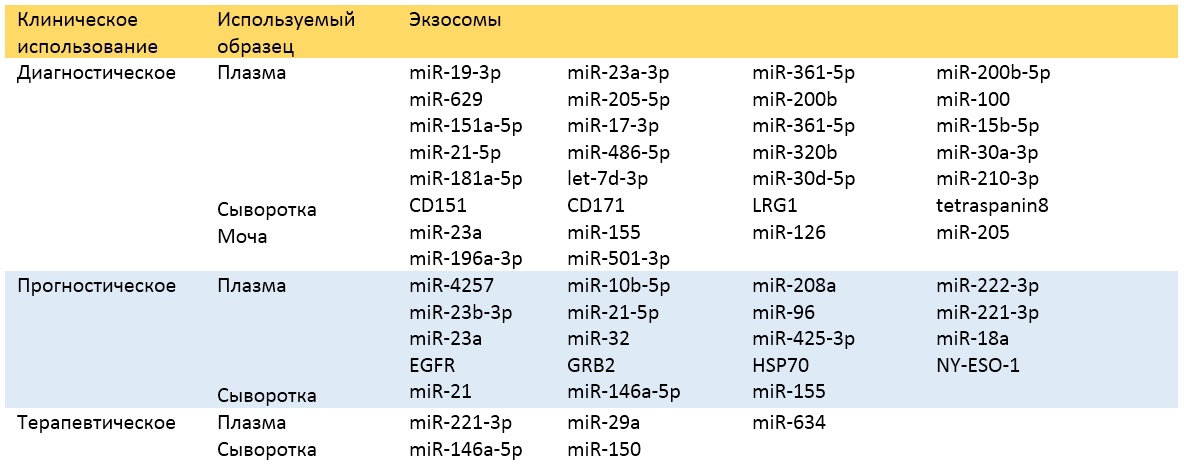
EGFR: Рецептор эпидермального фактора роста; GRB2: Growth factor receptor-bound protein 2; HSP70: протеин теплового шока 70; LRG1: Leucine rich alpha-2-glycoprotein 1; NY-ESO-1: Cancer-testis antigen NY-ESO-1.
Средство доставки (лекарства, вакцины, протеины и нуклеиновые кислоты)
Экзосомы, дериваты различных источников, таких как MSC, опухолевые клетки и иммунные клетки, используются в качестве носителя для доставки большого количества молекул, включая лекарственные препараты, нуклеиновые кислоты и природные фитохимические вещества. Биологически активные соединения могут быть обнаружены внутри экзосом или связаны с их поверхностными молекулами. Из-за своих амфифильных характеристик они могут нести и гидрофобные, и гидрофильные молекулы.
Для загрузки терапевтических молекул в систему доставки этого типа использовались различные методы загрузки, включая простую инкубацию, обработку ультразвуком, электропорацию, циклы замораживания-оттаивания и экструзию, среди прочих, с клетками из различных типов тканей (например, головного мозга) в качестве мишени [12,158]. Для восстановления мембран одна из физических процедур включает несколько циклов обработки ультразвуком с последующей инкубацией при 37°C [151, 158, 159]. Для электропорации экзосом лекарственные молекулы проникают через временные мембранные поры, создаваемые электрическими импульсами [160]. В целом, гидрофобные молекулы легче проникают через экзосомальную мембрану, тогда как гидрофильные соединения имеют низкую эффективность диффузии и требуют модификации молекулы или увеличения проницаемости мембраны физическими или химическими методами. В сравнении различных методов инкапсуляции фармацевтических препаратов и генетического груза в экзосомах обработка ультразвуком обеспечивает наиболее эффективную инкапсуляцию. Последствия такой мембранной обработки требуют дополнительных исследований. Кроме того, как и в случае изоляционных методов, для клинических применений требуются стандартизация, воспроизводимость и масштабируемость процедуры инкапсуляции. Экзосомы, содержащие терапевтические молекулы, такие как препараты и вакцины, можно вводить внутривенно, внутрибрюшинно, интраназально, подкожно или перорально in vivo.
Экзосомы имеют ряд преимуществ в качестве средств доставки, включая минимальную иммуногенность, длительную безопасность и отсутствие цитотоксичности [161–163]. Традиционные методы доставки miRNA, протеинов и химических препаратов часто не достигают желаемых эффектов по целому ряду причин: свободная miRNA быстро разрушается in vivo, протеины не имеют нативной конформации, а химические препараты могут вызывать высокую токсичность для нормальных клеток. Однако использование экзосом в качестве носителей может защитить miRNA от деградации рибонуклеазой в жидкостях организма, поэтому доставка груза на основе экзосом в опухолевые клетки имеет большие перспективы [12, 161–163]. Экзосомы активно изучаются в качестве терапевтических агентов, либо сами по себе, либо в качестве средств доставки лекарственных препаратов или вакцин. При экзогенном введении мышам экзосомы более эффективно проникают в другие клетки, чем липосомы, и могут доставлять функциональный груз с меньшим иммунным клиренсом [51, 164–167]. Обогащение экзосом на основе презентации их поверхностного лиганда может вести к развитию рецептор-опосредованного таргетинга тканей. Сконструированные экзосомы с обогащением лигандами также можно использовать для стимуляции или ингибирования сигнальных процессов в клетках-реципиентах или для таргетирования экзосомами определенных типов клеток [12,32,51,164–167].
Экзосомы могут служить не только потенциальными биомаркерами в медицине, но и очень ценным и эффективным «нановектором» для доставки противоопухолевых лекарственных соединений к тканям-мишеням с минимальной иммуногенностью и токсичностью благодаря их биологическому происхождению по сравнению с обычными средствами доставки лекарств в противоопухолевой терапии [168–170]. Экзосомы могут использоваться в качестве средства доставки лекарств к клеткам-мишеням, поскольку они малы, нетоксичны, неиммуногенны и нативны для человека. Состав их мембран аналогичен составу клеточных мембран организма, они имеют длительный период жизни в системе кровообращения, так как защищены от деградации рибонуклеазами [168]. Характерные свойства экзосом по доставке содержимого функционального груза в больные клетки делают их привлекательными в качестве терапевтических средств как на фундаментальном, так и на прикладном уровне. Исследователи недавно разработали естественные наноэкзосомы, систему доставки лекарств, основанную на конъюгации наночастиц золота с противораковым препаратом доксорубицином и присоединении их к рН-чувствительному гидразону экзосом [62]. В другом подходе наночастицы (например, золото, оксид железа и лекарственные препараты), покрытые экзосомами, использовались для адресной доставки терапевтических и визуализирующих агентов в определенные области [171,172].
Экзосомы, которые были созданы таким образом, чтобы нести на своей поверхности препараты или экспрессировать особые молекулы, открыли новые возможности в лечении многих заболеваний. Генная инженерия экзосом — удобный способ придать экзосомам новые характеристики. Модификация экзосомальной поверхности, например, клеточная трансгенная экспрессия, химическая модификация, электростатическое взаимодействие и мембрана-анчоринговая платформа, может усилить таргетинг и эффективность [12]. Для начала лиганды или хоминговые пептиды сращивают с экспрессируемыми на поверхности экзосом трансмембранными протеинами. LAMP-2B в настоящее время является наиболее широко используемым экзосомальным поверхностным протеином с таргетирующей последовательностью. LAMP-2B принадлежит к семейству лизосома-ассоциированных мембранных протеинов (LAMP), которые преимущественно найдены в лизосомах и эндосомах, с небольшим количеством, мигрирующим на клеточную поверхность [173]. Процедуры генной инженерии используются для генетического слияния таргетирующего лиганда с протеином экзосомальной внешней мембраны, который затем гиперэкспрессируется в донорских клетках-мишенях. В результате донорские клетки продуцируют экзосомы, которые были генетически модифицированы для переноски таргетирующего лиганда. Для отображения функциональных лигандов на экзосомальной мембране генная инженерия экзосом является высокоэффективной стратегией.
Экзосомы различного клеточного происхождения имеют разные поверхностные анчоринговые молекулы, что позволяет им таргетировать определенные клетки-реципиенты. Поверхностная инженерия направлена на повышение концентрации экзосом в пораженном участке, снижение токсичности и побочных эффектов с одновременным повышением терапевтической эффективности. Хотя поверхностная инженерия обычно используется для адресной лекарственной доставки, мало что известно о том, как она влияет на стабильность экзосом, пути проникновения в клетки и распределение тканей в системе in vivo. Экзосомы с большим количеством антигенов заболевания или специфичные хемокины могут успешно задействовать иммунные клетки в очаги болезни и индуцировать аномальную клеточно-специфическую цитотоксичность.
Заключение
Экзосомы исследуются как многокомпонентные сигнальные комплексы, обеспечивающие коммуникацию между близлежащими и удаленными клетками. Их также изучают в качестве средства доставки экзомального груза, включающего протеины, нуклеиновые кислоты, лекарственные препараты и вакцины. Экзосомы являются эффективным средством доставки груза благодаря их естественным характеристикам нетоксичности и низкой иммуногенности, а также их способности достигать особых таргетных клеток в любом месте организма вследствие небольшого размера [15, 174–176].
Современные данные о содержимом здоровых и болезнь-дериватных экзосом показали, что эти везикулы включают в себя разнообразный сигнальный материал, способный инициировать патогенез, а также их профили нуклеиновых кислот и протеинов, которые отличаются от экзосом здоровых клеток [60]. Фармацевтические препараты, такие как РНК терапевтические экзосомы, постепенно превратились в терапию заболеваний. Экзосомы с нанотехнологическими модификациями, в частности, обладают более высокой биосовместимостью и, ожидается, станут «будущим» терапевтических вакцин [177].
Как результат экзосомы являются отличной системой доставки в заболеваниях, включающих нейродегенерацию, рак и другие болезни, благодаря своей биосовместимости, низкой токсичности и иммуногенности, высокой стабильности в физиологических жидкостях, способности пересекать различные биологические барьеры и способности переносить специфичные молекулы (например, протеины, miRNA, антисмысловые олигонуклеотиды, препараты и вакцины) в клетки-мишени. Экзосомы имеют инновационные и важные применения в лечении заболеваний, но еще предстоит решить некоторые проблемы. Методы экзосомального анализа должны использовать небольшие объемы образцов, быть быстрыми, сенситивными, специфичными, с высоко продуктивными с высокой чистотой, низкой стоимостью и клинической валидацией для применения в клинической практике. Очистка, обогащение, чистота источника и валидация образца являются критическими факторами для использования экзосомальных miRNA в качестве клинических биомаркеров в жидкой биопсии. Хотя применение экзосом и их биомаркеров в настоящее время ограничено, ожидается, что клиническое использование этих биомолекул и их биомаркеров будет доступно в ближайшее время.
Литература:
- Pan BT, Johnstone RM. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro selective externalization of the receptor. Cell 33, 967–978 (1983). [PubMed] [Google Scholar]
- Dilsiz N. Role of exosomes and exosomal microRNAs in cancer. Future Sci. OA. 6, 1–15 (2020). [PMC free article] [PubMed] [Google Scholar]
- Ludwig AK, Giebel B. Exosomes: small vesicles participating in intercellular communication. Int. J. Biochem. Cell Biol. 44(1), 11–15 (2012). [PubMed] [Google Scholar]
- Raposo G, Stoorvogel W. Extracellular vesicles exosomes micro vesicles and friends. J. Cell Biol. 200, 373–383 (2013). [PMC free article] [PubMed] [Google Scholar]
- Tomasetti M, Lee W, Santarelli L, Neuzil J. Exosome-derived microRNAs in cancer metabolism: possible implications in cancer diagnostics and therapy. Exp. Mol. Med. 49(1), e285–e285 (2017). [PMC free article] [PubMed] [Google Scholar]
- Kowal J, Tkach M, Théry C. Biogenesis and secretion of exosomes. Curr. Opin. Cell Biol. 29, 116–125 (2014). [PubMed] [Google Scholar]
- Dreyer F, Baur A. Biogenesis and functions of exosomes and extracellular vesicles. Methods Mol. Biol. 1448, 201–216 (2016). [PubMed] [Google Scholar]
- Wang Y, Xu YM, Zou YQ et al. Identification of differential expressed PE exosomal miRNA in lung adenocarcinoma, tuberculosis, and other benign lesions. Medicine (Baltimore) 96(44), e8361 (2017). [PMC free article] [PubMed] [Google Scholar]
- Wang B, Xing D, Zhu Y, Dong S, Zhao B. The state of exosomes research: a global visualized analysis. BioMed Res. Int. 2019, 1–10 (2019). [Google Scholar]
- Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science 367(6478), eaau6977 (2020). [PMC free article] [PubMed] [Google Scholar]
- Bhattacharyya K, Mukherjee S. Fluorescent metal nano-clusters as next generation fluorescent probes for cell imaging and drug delivery. Bull. Chem. Soc. Jpn 91(3), 447–454 (2018). [Google Scholar]
- (. Pi YN, Xia BR, Jin MZ, Jin WL, Lou G. Exosomes: powerful weapon for cancer nano-immunoengineering. Biochem. Pharmacol. 186, 114487 2021). [PubMed] [Google Scholar]
- Lu M, Xing H, Xun Z et al. Exosome-based small RNA delivery: progress and prospects. Asian J. Pharm. Sci. 13(1), 1–11 (2018). [PMC free article] [PubMed] [Google Scholar]
- Wahlgren J, Karlson TDL, Brisslert M et al. Plasma exosomes can deliver exogenous short interfering RNA to monocytes and lymphocytes. Nucleic Acids Res. 40(17), e130–e130 (2012). [PMC free article] [PubMed] [Google Scholar]
- Samanta S, Rajasingh S, Drosos N et al. Exosomes new molecular targets of diseases. Acta Pharm. Sin. 39, 501–513 (2017). [PMC free article] [PubMed] [Google Scholar]
- Cappello F, Logozzi M, Campanella C et al. Exosome levels in human body fluids: a tumor marker by themselves? Eur. J. Pharm. Sci. 96, 93–98 (2017). [PubMed] [Google Scholar]
- Théry C, Witwer KW, Aikawa E et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J. Extracell. Vesicles 7(1), 1535750 (2018). [PMC free article] [PubMed] [Google Scholar]
- Shurtleff MJ, Temoche-Diaz MM, Schekman R. Extracellular vesicles and cancer: caveat lector. Annu. Rev. Cancer Biol. 2, 395–411 (2018). [Google Scholar]
- Jeppesen DK, Fenix AM, Franklin JL et al. Reassessment of exosome composition. Cell 177(2), 428–445 (2019). [PMC free article] [PubMed] [Google Scholar]
- Willms E, Cabañas C, Mäger I, Wood MJ, Vader P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Front. Immunol. 9, 738 (2018). [PMC free article] [PubMed] [Google Scholar]
- Gurung S, Perocheau D, Touramanidou L, Baruteau J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Commun. Signal. 19(1), 1–19 (2021). [PMC free article] [PubMed] [Google Scholar]
- Buschow SI, Anderton SM, Stoorvogel W, Wauben MH. Activated T cells recruit exosomes secreted by dendritic cells via LFA-1. Blood 113(9), 1977–1981 (2009). [PubMed] [Google Scholar]
- Ratajczak J, Miekus K, Kucia M et al. Embryonic stem cell-derived microvesicles reprogram hematopoietic progenitors: evidence for horizontal transfer of mRNA and protein delivery. Leukemia 20(5), 847–856 (2006). [PubMed] [Google Scholar]
- Zhang B, Wang M, Gong A et al. HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing. Stem Cells 33(7), 2158–2168 (2015). [PubMed] [Google Scholar]
- Cui X, He Z, Liang Z, Chen Z, Wang H, Zhang J. Exosomes from adipose-derived mesenchymal stem cells protect the myocardium against ischemia/reperfusion injury through Wnt/β-catenin signaling pathway. J. Cardiovasc. Pharmacol. 70(4), 225 (2017). [PMC free article] [PubMed] [Google Scholar]
- Men Y, Yelick J, Jin S et al. Exosome reporter mice reveal the involvement of exosomes in mediating neuron to astroglia communication in the CNS. Nat. Commun. 10(1), 1–18 (2019). [PMC free article] [PubMed] [Google Scholar]
- Bang C, Batkai S, Dangwal S et al. Cardiac fibroblast-derived microRNA passenger strand-enriched exosomes mediate cardiomyocyte hypertrophy. J. Clin. Invest. 124(5), 2136–2146 (2014). [PMC free article] [PubMed] [Google Scholar]
- Zamani P, Fereydouni N, Butler AE, Navashenaq JG, Sahebkar A. The therapeutic and diagnostic role of exosomes in cardiovascular diseases. Trends Cardiovasc. Med. 29(6), 313–323 (2019). [PubMed] [Google Scholar]
- Howitt J, Hill AF. Exosomes in the pathology of neurodegenerative diseases. J. Biol. Chem. 291(52), 26589–26597 (2016). [PMC free article] [PubMed] [Google Scholar]
- Osaki M, Okada F. Exosomes and their role in cancer progression. Yonago Acta. Medica. 62(2), 182–190 (2019). [PMC free article] [PubMed] [Google Scholar]
- Deng ZB, Liu Y, Liu C et al. Immature myeloid cells induced by a high-fat diet contribute to liver inflammation. Hepatology 50(5), 1412–1420 (2009). [PMC free article] [PubMed] [Google Scholar]
- Hade MD, Suire CS, Suo Z. Mesenchymal stem cell-derived exosomes: applications in regenerative medicine. Cells 10, 1959 (2021). [PMC free article] [PubMed] [Google Scholar]
- Zhang Y, Liu Y, Liu H, Tang WH. Exosomes: biogenesis, biologic function and clinical potential. Cell Biosci. 9(1), 1–18 (2019). [PMC free article] [PubMed] [Google Scholar]
- Haney MJ, Klyachko NL, Zhao Y et al. Exosomes as drug delivery vehicles for Parkinson’s disease therapy. J. Control. Rel. 207, 18–30 (2015). [PMC free article] [PubMed] [Google Scholar]
- Bunggulawa EJ, Wang W, Yin T et al. Recent advancements in the use of exosomes as drug delivery systems. Nanobiotechnology 16(1), 1–13 (2018). [PMC free article] [PubMed] [Google Scholar]
- Wu J, Shen Z. Exosomal miRNAs as biomarkers for diagnostic and prognostic in lung cancer. Cancer Med. 9(19), 6909–6922 (2020). [PMC free article] [PubMed] [Google Scholar]
- Thakur A, Parra DC, Motallebnejad P, Brocchi M, Chen HJ. Exosomes: small vesicles with big roles in cancer, vaccine development, and therapeutics. Bioact. Mater. 9, 1–14 (2021). [Google Scholar]
- Adlakha YK, Seth P. The expanding horizon of microRNAs in cellular reprogramming. Prog. Neurobiol. 148, 21–39 (2017). [PubMed] [Google Scholar]
- Yao Q, Chen Y, Zhou X. The roles of microRNAs in epigenetic regulation. Curr. Opin. Chem. Biol. 51, 11–17 (2019). [PubMed] [Google Scholar]
- Moutinho C, Esteller M. MicroRNAs and epigenetics. Adv. Cancer Res. 135, 189–220 (2017). [PubMed] [Google Scholar]
- Fabbri M, Garzon R, Cimmino A et al. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B. Proc. Natl Acad. Sci. 104(40), 15805–15810 (2007). [PMC free article] [PubMed] [Google Scholar]
- Garzon R, Liu S, Fabbri M et al. MicroRNA-29b induces global DNA hypomethylation and tumor suppressor gene reexpression in acute myeloid leukemia by targeting directly DNMT3A and 3B and indirectly DNMT1. Blood 113(25), 6411–6418 (2009). [PMC free article] [PubMed] [Google Scholar]
- Tu J, Liao J, Luk AC, Tang NL, Chan WY, Lee TL. MicroRNAs mediated targeting on the Yin-yang dynamics of DNA methylation in disease and development. Int. J. Biochem. Cell Biol. 67, 115–120 (2015). [PubMed] [Google Scholar]
- Taguchi YH. Apparent microRNA-target-specific histone modification in mammalian spermatogenesis. Evol. Bioinform. Online 11(Suppl. 1), 13–26 (2015). [PMC free article] [PubMed] [Google Scholar]
- Mens MM, Ghanbari M. Cell cycle regulation of stem cells by microRNAs. Stem Cell Rev. Rep. 14(3), 309–322 (2018). [PMC free article] [PubMed] [Google Scholar]
- Hao J, Duan FF, Wang Y. MicroRNAs and RNA binding protein regulators of microRNAs in the control of pluripotency and reprogramming. Curr. Opin. Genet. Dev. 46, 95–103 (2017). [PubMed] [Google Scholar]
- Li XJ, Ren ZJ, Tang JH, Yu Q. Exosomal MicroRNA MiR-1246 promotes cell proliferation, invasion and drug resistance by targeting CCNG2 in breast cancer. Cell. Physiol. Biochem. 44(5), 1741–1748 (2017). [PubMed] [Google Scholar]
- Lichner Z, Páll E, Kerekes A et al. The miR-290-295 cluster promotes pluripotency maintenance by regulating cell cycle phase distribution in mouse embryonic stem cells. Differentiation 81(1), 11–24 (2011). [PubMed] [Google Scholar]
- Markopoulos GS, Roupakia E, Tokamani M et al. A step-by-step microRNA guide to cancer development and metastasis. Cellular Onco. 40(4), 303–339 (2017). [PubMed] [Google Scholar]
- Antonyak MA, Cerione RA. Micro vesicles as mediators of intercellular communication in cancer. Methods Mol. Biol. 1165, 147–173 (2014). [PubMed] [Google Scholar]
- Kalluri R. The biology and function of exosomes in cancer. J. Clin. Investig. 126(4), 1208–1215 (2016). [PMC free article] [PubMed] [Google Scholar]
- Mathieu M, Martin-Jaular L, Lavieu G, Théry C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat. Cell Biol. 21(1), 9–17 (2019). [PubMed] [Google Scholar]
- Baretti M, Le DT. DNA mismatch repair in cancer. Pharmacol. Ther. 189, 45–62 (2018). [PubMed] [Google Scholar]
- Judson RL, Babiarz JE, Venere M, Blelloch R. Embryonic stem cell–specific microRNAs promote induced pluripotency. Nat. Biotechnol. 27(5), 459–461 (2009). [PMC free article] [PubMed] [Google Scholar]
- Lin SL, Chang DC, Chang-Lin S et al. Mir-302 reprograms human skin cancer cells into a pluripotent ES-cell-like state. RNA 14(10), 2115–2124 (2008). [PMC free article] [PubMed] [Google Scholar]
- Miyoshi N, Ishii H, Nagano H et al. Reprogramming of mouse and human cells to pluripotency using mature microRNAs. Cell Stem Cell 8(6), 633–638 (2011). [PubMed] [Google Scholar]
- Samavarchi-Tehrani P, Golipour A, David L. Functional genomics reveals a BMP-driven mesenchymal-to-epithelial transition in the initiation of somatic cell reprogramming. Cell Stem Cell 7(1), 64–77 (2010). [PubMed] [Google Scholar]
- Li N, Long B, Han W, Yuan S, Wang K. microRNAs: important regulators of stem cells. Stem Cell Res. Ther. 8(1), 1–7 (2017). [PMC free article] [PubMed] [Google Scholar]
- Zeng ZL, Lin XL, Tan LL, Liu YM, Qu K, Wang Z. MicroRNAs: important regulators of induced pluripotent stem cell generation and differentiation. Stem Cell Rev. Rep. 14(1), 71–81 (2018). [PubMed] [Google Scholar]
- Stefanius K, Servage K, Orth K. Exosomes in cancer development. Curr. Opin. Genet. Dev. 66, 83–92 (2021). [PubMed] [Google Scholar]
- Xue X, Wang X, Zhao Y, Hu R, Qin L. Exosomal miR-93 promotes proliferation and invasion in hepatocellular carcinoma by directly inhibiting TIMP2/TP53INP1/CDKN1A. Biochem. Biophys. Res. Commun. 502(4), 515–521 (2018). [PubMed] [Google Scholar]
- Xu K, Zhang C, Du T et al. Progress of exosomes in the diagnosis and treatment of lung cancer. Biomed. Pharmacother. 134, 111111 (2021). [PubMed] [Google Scholar]
- Sun Z, Shi K, Yang S et al. Effect of exosomal miRNA on cancer biology and clinical applications. Mol. Cancer 17(1), 1–19 (2018). [PMC free article] [PubMed] [Google Scholar]
- Li X, Corbett AL, Taatizadeh E et al. Challenges and opportunities in exosome research-perspectives from biology, engineering, and cancer therapy. APL Bioeng. 3(1), 011503 (2019). [PMC free article] [PubMed] [Google Scholar]
- Meehan K, Vella LJ. The contribution of tumour-derived exosomes to the hallmarks of cancer. Crit. Rev. Clin. Lab. Sci. 53(2), 121–131 (2016). [PubMed] [Google Scholar]
- Qu JL, Qu XJ, Zhao MF et al. Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation. Dig. Liver Dis. 41(12), 875–880 (2009). [PubMed] [Google Scholar]
- Li C, Liu DR, Li GG et al. CD97 promotes gastric cancer cell proliferation and invasion through exosome-mediated MAPK signaling pathway. World J. Gastroenterol. 21(20), 6215 (2015). [PMC free article] [PubMed] [Google Scholar]
- Yang L, Wu XH, Wang D, Luo CL, Chen LX. Bladder cancer cell-derived exosomes inhibit tumor cell apoptosis and induce cell proliferation in vitro. Mol. Med. Rep. 8(4), 1272–1278 (2013). [PubMed] [Google Scholar]
- Sento S, Sasabe E, Yamamoto T. Application of a persistent heparin treatment inhibits the malignant potential of oral squamous carcinoma cells induced by tumor cell-derived exosomes. PLoS ONE 11(2), e0148454 (2016). [PMC free article] [PubMed] [Google Scholar]
- Janowska-Wieczorek A, Wysoczynski M, Kijowski J et al. Microvesicles derived from activated platelets induce metastasis and angiogenesis in lung cancer. Int. J. Cancer 113(5), 752–760 (2005). [PubMed] [Google Scholar]
- Webber J, Steadman R, Mason MD, Tabi Z, Clayton A. Cancer exosomes trigger fibroblast to myofibroblast differentiation. Cancer Res. 70(23), 9621–9630 (2010). [PubMed] [Google Scholar]
- Webber JP, Spary LK, Sanders AJ et al. Differentiation of tumour-promoting stromal myofibroblasts by cancer exosomes. Oncogene 34(3), 290–302 (2015). [PubMed] [Google Scholar]
- Kalluri R, Zeisberg M. Fibroblasts in cancer. Nat. Rev. Cancer 6(5), 392–401 (2006). [PubMed] [Google Scholar]
- Goulet CR, Bernard G, Tremblay S, Chabaud S, Bolduc S, Pouliot F. Exosomes induce fibroblast differentiation into cancer-associated fibroblasts through TGFβ signaling. Mol. Cancer Res. 16(7), 1196–1204 (2018). [PubMed] [Google Scholar]
- Melo SA, Sugimoto H, O’Connell JT et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis. Cancer Cell 26(5), 707–721 (2014). [PMC free article] [PubMed] [Google Scholar]
- Abd Elmageed ZY, Yang Y, Thomas R et al. Neoplastic reprogramming of patient-derived adipose stem cells by prostate cancer cell-associated exosomes. Stem Cells 32(4), 983–997 (2014). [PMC free article] [PubMed] [Google Scholar]
- Marson A, Levine SS, Cole MF et al. Connecting microRNA genes to the core transcriptional regulatory circuitry of embryonic stem cells. Cell 134(3), 521–533 (2008). [PMC free article] [PubMed] [Google Scholar]
- Sluijter JP, van Mil A, van Vliet P. MicroRNA-1 and-499 regulate differentiation and proliferation in human-derived cardiomyocyte progenitor cells. Arterioscler. Thromb. Vasc. Biol. 30(4), 859–868 (2010). [PubMed] [Google Scholar]
- Glass C, Singla DK. MicroRNA-1 transfected embryonic stem cells enhance cardiac myocyte differentiation and inhibit apoptosis by modulating the PTEN/Akt pathway in the infarcted heart. Am. J. Physiol. Heart Circ. Physiol. 301(5), H2038–H2049 (2011). [PMC free article] [PubMed] [Google Scholar]
- Xie C, Huang H, Sun X et al. MicroRNA-1 regulates smooth muscle cell differentiation by repressing Kruppel-like factor 4. Stem Cells Dev. 20(2), 205–210 (2011). [PMC free article] [PubMed] [Google Scholar]
- Chen T, Margariti A, Kelaini S et al. MicroRNA-199b modulates vascular cell fate during iPS cell differentiation by targeting the notch ligand jagged1 and enhancing VEGF signaling. Stem Cells 33(5), 1405–1418 (2015). [PMC free article] [PubMed] [Google Scholar]
- Cheng LC, Pastrana E, Tavazoie M, Doetsch F. miR-124 regulates adult neurogenesis in the subventricular zone stem cell niche. Nat. Neurosci. 12(4), 399 (2009). [PMC free article] [PubMed] [Google Scholar]
- Agostini M, Tucci P, Steinert JR et al. microRNA-34a regulates neurite outgrowth, spinal morphology, and function. Proc. Natl Acad. Sci. USA 108(52), 21099–21104 (2011). [PMC free article] [PubMed] [Google Scholar]
- Kim H, Lee G, Ganat Y et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell 8(6), 695–706 (2011). [PubMed] [Google Scholar]
- Eskildsen T, Taipaleenmäki H, Stenvang J et al. MicroRNA-138 regulates osteogenic differentiation of human stromal (mesenchymal) stem cells in vivo. Proc. Natl Acad. Sci. USA 108(15), 6139–6144 (2011). [PMC free article] [PubMed] [Google Scholar]
- Ham O, Song BW, Lee SY et al. The role of microRNA-23b in the differentiation of MSC into chondrocyte by targeting protein kinase A signaling. Biomaterials 33(18), 4500–4507 (2012). [PubMed] [Google Scholar]
- Lin X, Wu L, Zhang Z et al. MiR-335-5p promotes chondrogenesis in mouse mesenchymal stem cells and is regulated through two positive feedback loops. J. Bone Miner. Res. 29(7), 1575–1585 (2014). [PubMed] [Google Scholar]
- Meenhuis A, van Veelen PA, de Looper H et al. MiR-17/20/93/106 promote hematopoietic cell expansion by targeting sequestosome 1-regulated pathways in mice. Blood 118(4), 916–925 (2011). [PMC free article] [PubMed] [Google Scholar]
- Chen CZ, Li L, Lodish HF, Bartel DP. MicroRNAs modulate hematopoietic lineage differentiation. Science 303(5654), 83–86 (2004). [PubMed] [Google Scholar]
- Wang X, Zhou Y, Ding K. Roles of exosomes in cancer chemotherapy resistance, progression, metastasis and immunity, and their clinical applications. Int. J. Oncol. 59(1), 1–18 (2021). [PMC free article] [PubMed] [Google Scholar]
- Zhao J, Schlößer HA, Wang Z et al. Tumor-derived extracellular vesicles inhibit natural killer cell function in pancreatic cancer. Cancers 11(6), 874 (2019). [PMC free article] [PubMed] [Google Scholar]
- Chen G, Huang AC, Zhang W et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature 560(7718), 382–386 (2018). [PMC free article] [PubMed] [Google Scholar]
- Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses. Nat. Rev. Immunol. 9(8), 581–593 (2009). [PubMed] [Google Scholar]
- Barros FM, Carneiro F, Machado JC, Melo SA. Exosomes and immune response in cancer: friends or foes? Front. Immunol. 9, 730 (2018). [PMC free article] [PubMed] [Google Scholar]
- Quah BJ, O’Neill HC. The immunogenicity of dendritic cell-derived exosomes. Blood Cells Mol. Dis. 35(2), 94–110 (2005). [PubMed] [Google Scholar]
- Romagnoli GG, Zelante BB, Toniolo PA, Migliori IK, Barbuto JAM. Dendritic cell-derived exosomes may be a tool for cancer immunotherapy by converting tumor cells into immunogenic targets. Front. Immunol. 5, 692 (2015). [PMC free article] [PubMed] [Google Scholar]
- Kugeratski FG, Kalluri R. Exosomes as mediators of immune regulation and immunotherapy in cancer. FEBS J. 288(1), 10–35 (2021). [PMC free article] [PubMed] [Google Scholar]
- Fernandes Ribeiro M, Zhu H, Millard R W, Fan GC. Exosomes function in pro-and anti-angiogenesis. Curr. Angiogenes. 2(1), 54–59 (2013). [PMC free article] [PubMed] [Google Scholar]
- Martial S. Involvement of ion channels and transporters in carcinoma angiogenesis and metastasis. Am. J. Physiol. Cell Physiol. 310, C710–C727 (2016). [PubMed] [Google Scholar]
- Umezu T, Ohyashiki K, Kuroda M, Ohyashiki JH. Leukemia cell to endothelial cell communication via exosomal miRNAs. Oncogene 32(22), 2747–2755 (2013). [PubMed] [Google Scholar]
- Sharghi-Namini S, Tan E, Ong LLS, Ge R, Asada HH. Dll4-containing exosomes induce capillary sprout retraction in a 3D microenvironment. Sci. Rep. 4(1), 1–8 (2014). [PMC free article] [PubMed] [Google Scholar]
- Dorayappan KDP, Wanner R, Wallbillich JJ et al. Hypoxia-induced exosomes contribute to a more aggressive and chemoresistant ovarian cancer phenotype: a novel mechanism linking STAT3/Rab proteins. Oncogene 37(28), 3806–3821 (2018). [PMC free article] [PubMed] [Google Scholar]
- Mao Y, Wang Y, Dong L et al. Hypoxic exosomes facilitate angiogenesis and metastasis in esophageal squamous cell carcinoma through altering the phenotype and transcriptome of endothelial cells. J. Exp. Clin. Cancer Res. 38(1), 1–14 (2019). [PMC free article] [PubMed] [Google Scholar]
- Ludwig N, Whiteside TL. Potential roles of tumor-derived exosomes in angiogenesis. Expert Opin. Ther. Targets 22(5), 409–417 (2018). [PMC free article] [PubMed] [Google Scholar]
- Zhou W, Fong MY, Min Y et al. Cancer-secreted miR-105 destroys vascular endothelial barriers to promote metastasis. Cancer Cell 25(4), 501–515 (2014). [PMC free article] [PubMed] [Google Scholar]
- Umezu T, Tadokoro H, Azuma K, Yoshizawa S, Ohyashiki K, Ohyashiki JH. Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1. Blood 124(25), 3748–3757 (2014). [PMC free article] [PubMed] [Google Scholar]
- Martinelli C, Farooqi AA, Ismail M. Exosomes new biomarkers for targeted cancer therapy. In: Molecular Oncology Underlying Mechanisms and Translational Advancements Farooqi AA, Ismail M, Springer International Publishing, 129–157 (2017). [Google Scholar]
- Mentkowski KI, Snitzer JD, Rusnak S, Lang JK. Therapeutic potential of engineered extracellular vesicles. AAPS J. 20(3), 1–17 (2018). [PMC free article] [PubMed] [Google Scholar]
- Ma T, Chen Y, Chen Y et al. MicroRNA-132, delivered by mesenchymal stem cell-derived exosomes, promote angiogenesis in myocardial infarction. Stem Cells Int. 2018, 3290372 (2018). [PMC free article] [PubMed] [Google Scholar]
- Fortunato O, Gasparini P, Boeri M, Sozzi G. Exo-miRNAs as a new tool for liquid biopsy in lung cancer. Cancers 11(6), 888 (2019). [PMC free article] [PubMed] [Google Scholar]
- Deng T, Zhang H, Yang H et al. Exosome miR-155 derived from gastric carcinoma promotes angiogenesis by targeting the c-MYB/VEGF axis of endothelial cells. Mol. Ther. Nucleic Acids 19, 1449–1459 (2020). [PMC free article] [PubMed] [Google Scholar] Retracted
- Zhuang G, Wu X, Jiang Z et al. Tumour-secreted miR-9 promotes endothelial cell migration and angiogenesis by activating the JAK-STAT pathway. EMBO J. 31(17), 3513–3523 (2012). [PMC free article] [PubMed] [Google Scholar]
- Wu H, Wang Q, Zhong H et al. Differentially expressed microRNAs in exosomes of patients with breast cancer revealed by next-generation sequencing. Oncol. Rep. 43(1), 240–250 (2020). [PMC free article] [PubMed] [Google Scholar]
- Alečković M, McAllister SS, Polyak K. Metastasis as a systemic disease: molecular insights and clinical implications. Biochim. Biophys. Acta Rev. Cancer 1872(1), 89–102 (2019). [PMC free article] [PubMed] [Google Scholar]
- Clancy J, D’Souza-Schorey C. Extracellular vesicles in cancer purpose and promise. Cancer J. 24, 65–69 (2018). [PMC free article] [PubMed] [Google Scholar]
- Melo SA, Luecke LB, Kahlert C et al. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature 523(7559), 177–182 (2015). [PMC free article] [PubMed] [Google Scholar]
- Sharma A, Khatun Z, Shiras A. Tumor exosomes cellular postmen of cancer diagnosis and personalized therapy. J. Nanomedicine 11, 421–437 (2016). [PubMed] [Google Scholar]
- Syn N, Wang L, Sethi G, Thiery JP, Goh BC. Exosome-mediated metastasis: from epithelial–mesenchymal transition to escape from immunosurveillance. Trends Pharmacol. Sci. 37(7), 606–617 (2016). [PubMed] [Google Scholar]
- Wang N, Xie L. Diagnostic and therapeutic applications of tumorassociated exosomes. Precision Rad. Oncol. 1, 34–39 (2017). [Google Scholar]
- Zhang J, Li D, Zhang Y, Ding Z et al. Integrative analysis of mRNA and miRNA expression profiles reveals seven potential diagnostic biomarkers for non-small cell lung cancer. Oncol. Rep. 43(1), 99–112 (2020). [PMC free article] [PubMed] [Google Scholar]
- O’Neill S, O’Driscoll L. Profiling circulating miRNAs from the plasma of individuals with metabolic syndrome. Methods Mol. Biol. 13, 141–149 (2017). [PubMed] [Google Scholar]
- Dong H, Chen H, Jiang J, Zhang H, Cai C, Shen Q. Highly sensitive electrochemical detection of tumor exosomes based on aptamer recognition-induced multi-DNA release and cyclic enzymatic amplification. Anal. Chem. 90(7), 4507–4513 (2018). [PubMed] [Google Scholar]
- Sitar S, Kejžar A, Pahovnik D et al. Size characterization and quantification of exosomes by asymmetrical-flow field-flow fractionation. Anal. Chem. 87(18), 9225–9233 (2015). [PubMed] [Google Scholar]
- Van der Pol E, Coumans FAW, Grootemaat AE et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. J. Thromb. Haemost. 12(7), 1182–1192 (2014). [PubMed] [Google Scholar]
- Maas SL, Broekman ML, de Vrij J. Tunable resistive pulse sensing for the characterization of extracellular vesicles. In: Exosomes and Micro Vesicles. Hill AF (Ed.). 1545: 21–33; Humana Press, NY: (2017). [Google Scholar]
- Ma Z, Wei K, Yang F et al. Tumor-derived exosomal miR-3157-3p promotes angiogenesis, vascular permeability and metastasis by targeting TIMP/KLF2 in non-small cell lung cancer. Cell Death Dis. 12(9), 1–13 (2021). [PMC free article] [PubMed] [Google Scholar]
- Peinado H, Zhang H, Matei IR et al. Pre-metastatic niches: organ-specific homes for metastases. Nat. Rev. Cancer 17(5), 302 (2017). [PubMed] [Google Scholar]
- Costa-Silva B, Aiello NM, Ocean AJ et al. Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver. Nat. Cell Biol. 17(6), 816–826 (2015). [PMC free article] [PubMed] [Google Scholar]
- Plebanek MP, Angeloni NL, Vinokour E et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nat. Commun. 8(1), 1–12 (2017). [PMC free article] [PubMed] [Google Scholar]
- Hood JL, San RS, Wickline SA. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Res. 71(11), 3792–3801 (2011). [PubMed] [Google Scholar]
- Salehi M, Sharifi M. Exosomal miRNAs as novel cancer biomarkers: challenges and opportunities. J. Cell. Physiol. 233(9), 6370–6380 (2018). [PubMed] [Google Scholar]
- Thind A, Wilson C. Exosomal miRNAs as cancer biomarkers and therapeutic targets. J. Extracell. Vesicles 5(1), 31292 (2016). [PMC free article] [PubMed] [Google Scholar]
- Bhagirath D, Yang TL, Bucay N et al. microRNA-1246 is an exosomal biomarker for aggressive prostate cancer. Cancer Res. 78(7), 1833–1844 (2018). [PMC free article] [PubMed] [Google Scholar]
- Pigati L, Yaddanapudi SC, Iyengar R et al. Selective release of microRNA species from normal and malignant mammary epithelial cells. PloS ONE 5(10), e13515 (2010). [PMC free article] [PubMed] [Google Scholar]
- Sakha S, Muramatsu T, Ueda K, Inazawa J. Exosomal microRNA miR-1246 induces cell motility and invasion through the regulation of DENND2D in oral squamous cell carcinoma. Sci. Rep. 6(1), 1–11 (2016). [PMC free article] [PubMed] [Google Scholar]
- Gokita K, Inoue J, Ishihara H, Kojima K, Inazawa J. Therapeutic potential of LNP-mediated delivery of miR-634 for cancer therapy. Mol. Ther. Nucleic Acids 19, 330–338 (2020). [PMC free article] [PubMed] [Google Scholar]
- Alhasan AH, Scott AW, Wu JJ et al. Circulating microRNA signature for the diagnosis of very high-risk prostate cancer. Proceedings of the National Academy of Sciences. 113(38), 10655–10660 (2016). [PMC free article] [PubMed] [Google Scholar]
- Ebrahimkhani S, Vafaee F, Hallal S et al. Deep sequencing of circulating exosomal microRNA allows non-invasive glioblastoma diagnosis. NPJ Precis. Oncol. 2(1), 1–9 (2018). [PMC free article] [PubMed] [Google Scholar]
- Halvaei S, Daryani S, Eslami SZ et al. Exosomes in cancer liquid biopsy: a focus on breast cancer. Mol. Ther. Nucleic Acids 10, 131–141 (2018). [PMC free article] [PubMed] [Google Scholar]
- Stevic I, Müller V, Weber K et al. Specific microRNA signatures in exosomes of triple-negative and HER2-positive breast cancer patients undergoing neoadjuvant therapy within the GeparSixto trial. BMC Med. 16(1), 1–16 (2018). [PMC free article] [PubMed] [Google Scholar]
- Zhou X, Zhu W, Li H et al. Diagnostic value of a plasma microRNA signature in gastric cancer: a microRNA expression analysis. Sci. Rep. 5(1), 1–13 (2015). [PMC free article] [PubMed] [Google Scholar]
- Jin X, Chen Y, Chen H et al. Evaluation of tumor-derived exosomal miRNA as potential diagnostic biomarkers for early-stage non-small-cell lung cancer using next-generation sequencing. Clin. Cancer Res. 23(17), 5311–5319 (2017). [PubMed] [Google Scholar]
- Dinh TKT, Fendler W, Chałubińska-Fendler J et al. Circulating miR-29a and miR-150 correlate with delivered dose during thoracic radiation therapy for non-small cell lung cancer. Radiat. Oncol. 11(1), 1–11 (2016). [PMC free article] [PubMed] [Google Scholar]
- Zhou X, Wen W, Shan X et al. A six-microRNA panel in plasma was identified as a potential biomarker for lung adenocarcinoma diagnosis. Oncotarget 8(4), 6513 (2017). [PMC free article] [PubMed] [Google Scholar]
- Rabinowits G, Gerçel-Taylor C, Day JM, Taylor DD, Kloecker GH. Exosomal microRNA: a diagnostic marker for lung cancer. Clin. Lung Cancer 10(1), 42–46 (2009). [PubMed] [Google Scholar]
- Grimolizzi F, Monaco F, Leoni F et al. Exosomal miR-126 as a circulating biomarker in non-small-cell lung cancer regulating cancer progression. Sci. Rep. 7(1), 1–12 (2017). [PMC free article] [PubMed] [Google Scholar]
- Xu ZH, Miao ZW, Jiang QZ et al. Brain microvascular endothelial cell exosome-mediated S100A16 up-regulation confers small-cell lung cancer cell survival in brain. FASEB J. 33(2), 1742–1757 (2019). [PubMed] [Google Scholar]
- Wang J, Yeung BZ, Cui M et al. Exosome is a mechanism of intercellular drug transfer: application of quantitative pharmacology. J. Control. Rel. 268, 147–158 (2017). [PMC free article] [PubMed] [Google Scholar]
- Lai X, Friedman A. Exosomal miRs in lung cancer: a mathematical model. PLoS ONE 11(12), e0167706 (2016). [PMC free article] [PubMed] [Google Scholar]
- Manier S, Liu CJ, Avet-Loiseau H et al. Prognostic role of circulating exosomal miRNAs in multiple myeloma. Blood 129(17), 2429–2436 (2017). [PMC free article] [PubMed] [Google Scholar]
- Kim MS, Haney MJ, Zhao Y et al. Engineering macrophage-derived exosomes for targeted paclitaxel delivery to pulmonary metastases: in vitro and in vivo evaluations. Nanomedicine 14(1), 195–204 (2018). [PubMed] [Google Scholar]
- Bernard S, Agustriawan D. Identification of microRNA targeting cancer gene of colorectal carcinoma in caucasian population. 2019 International Conference on Information and Communications Technology (ICOIACT). IEEE, 423–427 (2019). [Google Scholar]
- Hsu YL, Hung JY, Chang WA et al. Hypoxic lung cancer-secreted exosomal miR-23a increased angiogenesis and vascular permeability by targeting prolyl hydroxylase and tight junction protein ZO-1. Oncogene 36(34), 4929–4942 (2017). [PubMed] [Google Scholar]
- Yuwen D, Ma Y, Wang D et al. Prognostic role of circulating exosomal miR-425-3p for the response of NSCLC to platinum-based chemotherapy. Cancer Epidemiol. Biomarkers Prev. 28(1), 163–173 (2019). [PubMed] [Google Scholar]
- Dejima H, Iinuma H, Kanaoka R, Matsutani N, Kawamura M. Exosomal microRNA in plasma as a non-invasive biomarker for the recurrence of non-small cell lung cancer. Oncol. Lett. 13(3), 1256–1263 (2017). [PMC free article] [PubMed] [Google Scholar]
- Clark DJ, Fondrie WE, Yang A, Mao L. Triple SILAC quantitative proteomic analysis reveals differential abundance of cell signaling proteins between normal and lung cancer-derived exosomes. J. Proteomics 133, 161–169 (2016). [PubMed] [Google Scholar]
- Kumata Y, Iinuma H, Suzuki Y et al. Exosome-encapsulated microRNA-23b as a minimally invasive liquid biomarker for the prediction of recurrence and prognosis of gastric cancer patients in each tumor stage. Oncol. Rep. 40(1), 319–330 (2018). [PubMed] [Google Scholar]
- Gutierrez-Millan C, Calvo Díaz C, Lanao JM, Colino CI. Advances in exosomes-based drug delivery systems. Macromol. Biosci. 21(1), 2000269 (2021). [PubMed] [Google Scholar]
- Yu M, Gai C, Li Z et al. Targeted exosome-encapsulated erastin induced ferroptosis in triple negative breast cancer cells. Cancer Sci. 110(10), 3173 (2019). [PMC free article] [PubMed] [Google Scholar]
- Schindler C, Collinson A, Matthews C et al. Exosomal delivery of doxorubicin enables rapid cell entry and enhanced in vitro potency. PLoS ONE 14(3), e0214545 (2019). [PMC free article] [PubMed] [Google Scholar]
- Alvarez-Erviti L, Seow Y, Yin H, Betts C, Lakhal S, Wood MJ. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat. Biotechnol. 29(4), 341–345 (2011). [PubMed] [Google Scholar]
- Ohno SI, Takanashi M, Sudo K et al. Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells. Mol. Ther. 21(1), 185–191 (2013). [PMC free article] [PubMed] [Google Scholar]
- Tian Y, Li S, Song J et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy. Biomaterials 35(7), 2383–2390 (2014). [PubMed] [Google Scholar]
- Fitts CA, Ji N, Li Y, Tan C. Exploiting exosomes in cancer liquid biopsies and drug delivery. Adv. Healthc. Mater. 8(6), 1801268 (2019). [PubMed] [Google Scholar]
- Barile L, Vassalli G. Exosomes: therapy delivery tools and biomarkers of diseases. Pharmacol. Ther. 174, 63–78 (2017). [PubMed] [Google Scholar]
- Van Woensel M, Wauthoz N, Rosière R et al. Development of siRNA-loaded chitosan nanoparticles targeting galectin-1 for the treatment of glioblastoma multiforme via intranasal administration. J. Control. Rel. 227, 71–81 (2016). [PubMed] [Google Scholar]
- Liao W, Du Y, Zhang C et al. Exosomes: the next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1–14 (2019). [PubMed] [Google Scholar]
- Cruz-Rodriguez L, Dilsiz N, Barea R et al. The algorithms Cruz Rodriguez (CR) are proposing a novel vaccine RNA-peptide against breast, ovarian, and lung cancers disease: exosomes as carrier in cancer progression and metastasis. J. Med.- Clin. Res. Rev. 5(2), 1–16 (2021). [Google Scholar]
- Bu H, He D, He X et al. Exosomes isolation analysis and applications in cancer detection and therapy. Chembiochem. 20, 451–461 (2019). [PubMed] [Google Scholar]
- Aqil F, Munagala R, Jeyabalan J, Agrawal AK, Gupta R. Exosomes for the enhanced tissue bioavailability and efficacy of curcumin. AAPS J. 19(6), 1691–1702 (2017). [PubMed] [Google Scholar]
- Illes B, Hirschle P, Barnert S, Cauda V, Wuttke S, Engelke H. Exosome-coated metal–organic framework nanoparticles: an efficient drug delivery platform. Chem. Mater. 29(19), 8042–8046 (2017). [Google Scholar]
- Fathi P, Rao L, Chen X. Extracellular vesicle-coated nanoparticles. View 2(2), 20200187 (2021). [Google Scholar]
- Liang Y, Duan L, Lu J, Xia J. Engineering exosomes for targeted drug delivery. Theranostics 11(7), 3183 (2021). [PMC free article] [PubMed] [Google Scholar]
- Ha D, Yang N, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes current perspectives and future challenges. Acta Pharm. Sin. B. 6, 287–296 (2016). [PMC free article] [PubMed] [Google Scholar]
- Datta A, Kim H, McGee L et al. High-throughput screening identified selective inhibitors of exosome biogenesis and secretion: a drug repurposing strategy for advanced cancer. Sci. Rep. 8(1), 1–13 (2018). [PMC free article] [PubMed] [Google Scholar]
- Von Schulze A, Deng F. A review on exosome-based cancer therapy. J. Cancer Metastasis Treat. 6, 1–10 (2020). [Google Scholar]
- Tang Z, Li D, Hou S, Zhu X. The cancer exosomes: clinical implications, applications and challenges. Int. J. Cancer 146(11), 2946–2959 (2020). [PubMed] [Google Scholar]