Введение
Непрерывная клеточная пролиферация, центральный характерный признак рака, возникает в результате появления раковых клеток (CC), рефрактерных к клеточной смерти и остановке клеточного цикла вследствие мутаций в онкогенах, опухоль-супрессорных генах и генах стабильности [1]. Выжившие CC клоны трансформируются в аваскулярный узел, который зависит от снабжения кислородом и нутриентами благодаря диффузии из кровеносных сосудов и обмену жидкостью с лимфатической системой [2], два процесса, которые теряют адекватность по мере прогрессирования рака [3, 4, 5] (вставка 1). Эта патобиологическая конвергенция высокой СС пролиферации, увеличения дистанций диффузии и аккумуляции интерстициальной жидкости результирует в гетерогенную опухолевую микросреду (TME), характеризующуюся гипоксией и отеком, в которой крутые градиенты О2 и давления интерстициальной жидкости (IFP) становятся типичным явлением [5, 6, 7]. CC отвечают на последующую диффузия-ограниченную гипоксию TME активацией транскрипционных и трансляционных программ (Фиг. 1), которые промотируют перестройку сосудистой сети хозяина, включая генерацию кровеносных (ангиогенез) и лимфатических (лимфангиогенез) сосудов из ранее существовавших [8,9]. Опухолевый ангиогенез и лимфангиогенез ведут к структурно и функционально аномальным сосудам, которые ухудшают снабжение сосудов кислородом, усугубляя различия IFP между опухолью и окружающими нормальными тканями [10, 11, 12, 13]. Эта адверзивная конфигурация TME усиливает гипоксию и соответствующие ей сигнальные пути (Фиг. 1) в петле прямой связи, повышая миграцию и инвазию CC в регионарные и отдаленные анатомические сайты (метастазы) в сосудистом контексте, что значительно ограничивает эффективность доставки препаратов [12,13].
Лимфатическая сосудистая сеть, подобно кровеносной системе [14], может модулировать прогрессирование рака благодаря способности своего эндотелия контролировать активность, пролиферацию, дифференцирование и созревание иммунных клеток [15, 16, 17, 18], эффективно связывающих патобиологические механизмы лимфатической перестройки с иммунотерапевтическими ответами [19]. Эта новая точка зрения согласуется с представлением о лимфатических сосудах не как о пассивных проводниках лимфотока, а как об активной клеточной структуре, контролирующей создание «иммуносупрессивного хаба» для CC, которое влияет на клинический ответ на стандартную и иммунную противораковую терапию.
| Вставка 1. Диффузия O2, гипоксия и лимфатическая TME
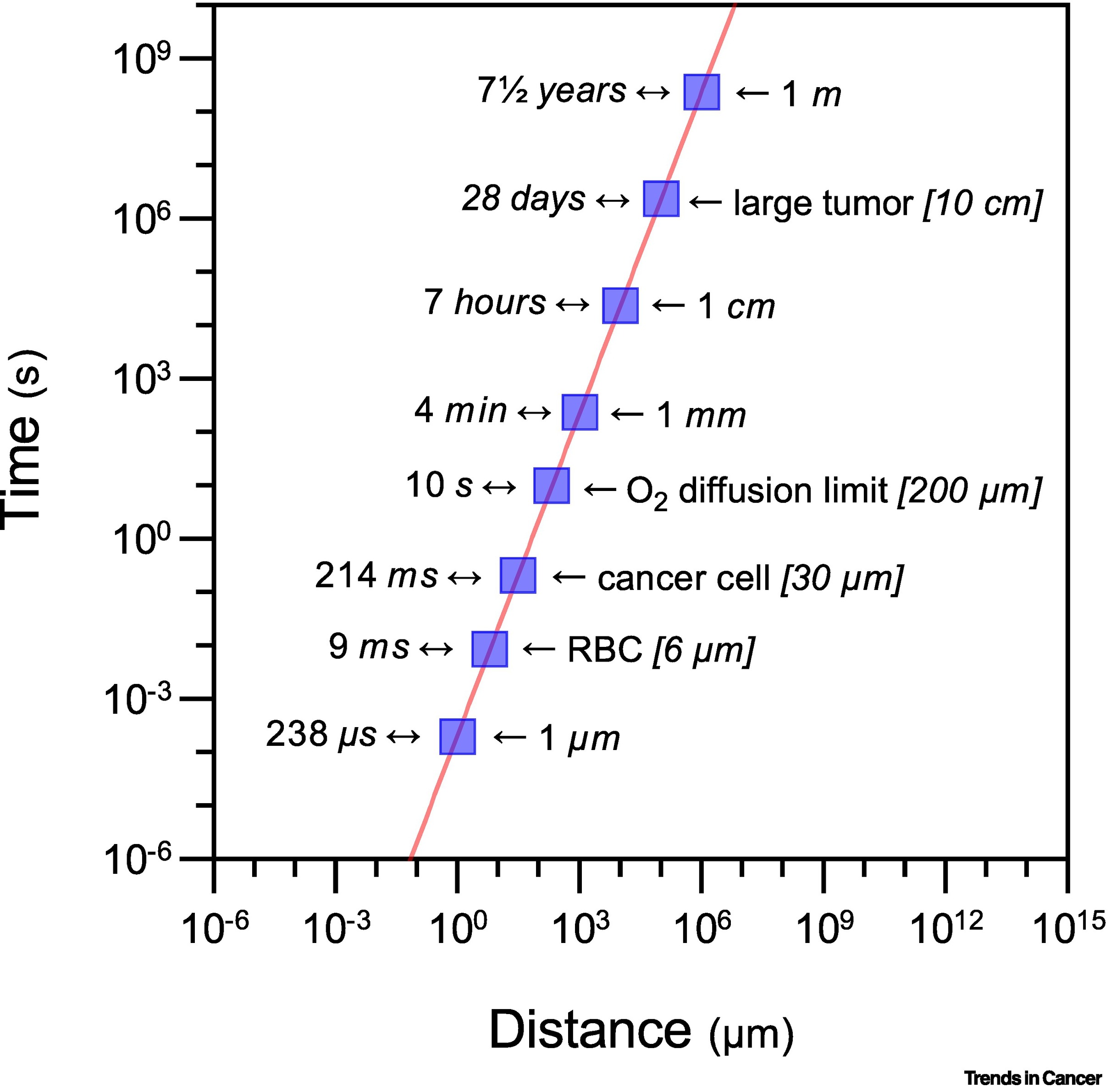
Канонически опухолевая гипоксия считается результатом несоответствия между доставкой и потреблением О2, завися от локальной плотности кровеносных сосудов и метаболической активности индивидуальных СС. Несмотря на эти факторы, время диффузии O2 и других малых молекул увеличивается экспоненциально с межклеточными расстояниями. В частности, среднее время диффузии O2 зависит от квадрата расстояния (т. е. когда расстояние удваивается, время диффузии увеличивается в четыре раза), принцип, сформулированный Альбертом Эйнштейном (Albert Einstein) и Мариан Риттер фон Смолан Смолуховски (Marian Ritter von Smolan Smoluchowski) (Фиг. I). В отношении лимфатического TME, скорость, с которой O2 может захватываться и утилизироваться CC в зарождающейся аваскулярной опухоли, сильно снижена вследствие дефицита лимфатического дренажа, что ведет к аккумуляции жидкости в интерстиции и может увеличивать межклеточные расстояния дополнительно благоприятствуя аккумуляции инфильтрирующих воспалительных/иммунных клеток. Предполагая постоянную опухолевую массу, уровни O2 и внеклеточные факторы, изменяя только расстояния диффузии O2, мы можем использовать уравнение Эйнштейна-Смолуховского, чтобы рассчитать, что O2 пройдет расстояние 1 мкм (одна пятая диаметра эритроцита) за несколько миллионных долей секунды; напротив, если той же молекуле O2 требуется пройти 1 мм (максимальный размер, которого может достичь опухоль без дополнительных кровеносных сосудов), время прохождения увеличится в 1 миллион раз, теперь требуется ≈4 мин. За границами 1-мм дистанции CC метаболизм может нарушаться, таким образом выдвигая на первый план центральную роль внутриопухолевых и перитуморальных лимфатических сосудов в гипоксической TME. Кроме того, эти расчеты, вероятно, занижают время диффузии, поскольку они предполагают диффузию O2 в чистой воде, игнорируя сложные макромолекулярные и клеточные элементы, находящиеся в интерстициальной среде опухолей.
Фиг. I. Взаимосвязь Эйнштейна-Смолуховского (Einstein-Smoluchowski) и диффузия О2. Центральную роль сосудистой перфузии и лимфотическом дренаже в условиях внутриопухолевой гипоксии можно проиллюстрировать графиком взаимосвязи между расстоянием диффузии кислорода и временем в чистой воде в 25°С, рассчитанной по уравнению Эйнштейна-Смолуховского. Расчеты предполагают коэффициент диффузии O2 равным 2,1 × 10-5 см2/с. Обе оси выражены в логарифмической шкале, таким образом, каждая галочка представляет увеличение в 10 раз. Указано время, необходимое для диффузии О2 молекул на расстояния, соответствующие опухолевому росту. Аббревиатуры: RBC, эритроцит. |
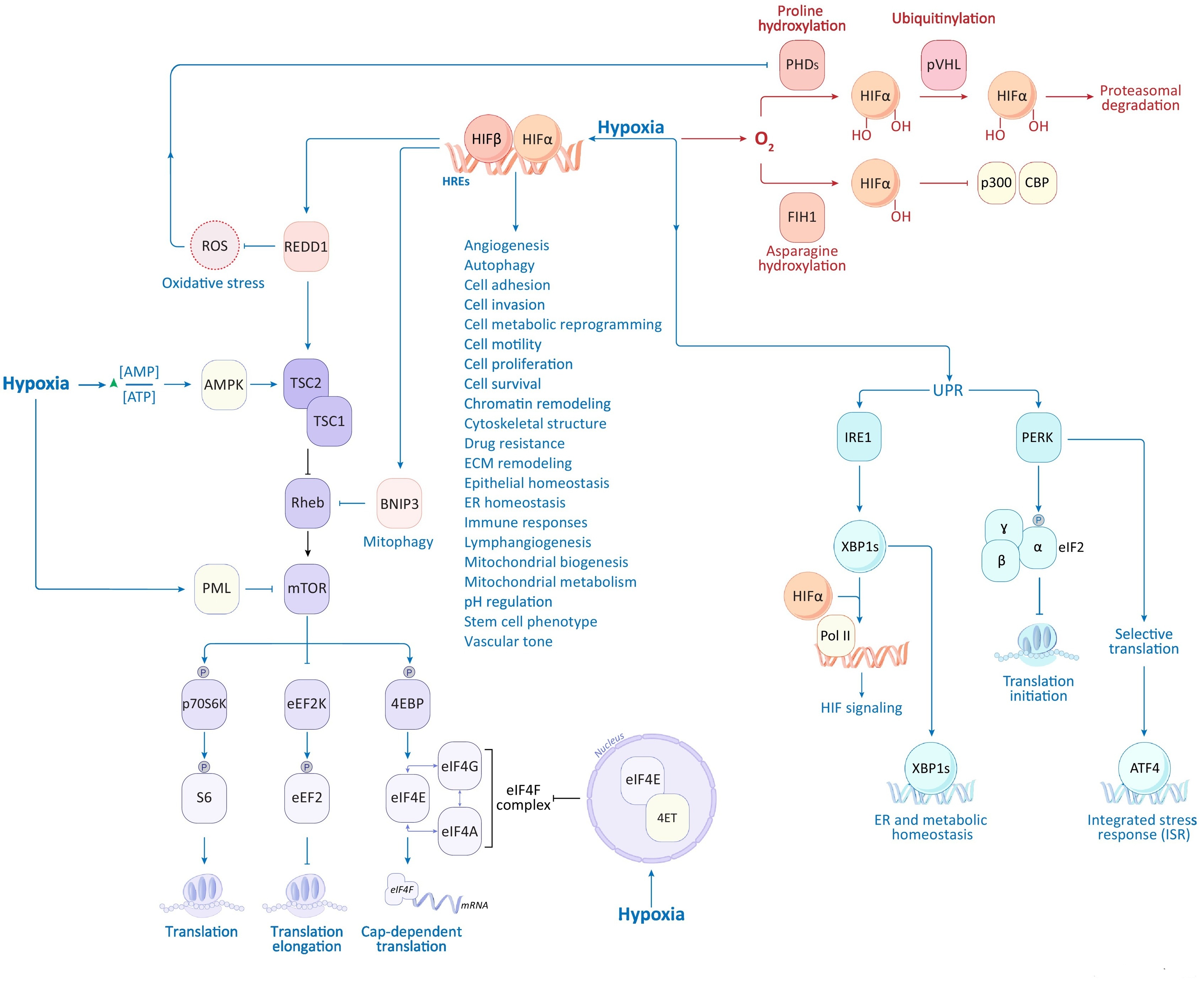
Фиг. 1. Гипоксический сигналинг в раковых клетках. Низкий O2 (гипоксия) трансдуцируется в раковых клетках в активацию транскрипции и ингибирование трансляции, по меньшей мере, тремя молекулярными путями. 1. Умеренная гипоксия (<2%) повышает транскрипционную активность HIF-α благодаря снижению PHD-зависимого пролил- и FIH-1-зависимого аспарагинил-гидроксилирования, результируя в повышенные уровни HIFα и связывания коактиватора CBP/p300, соответственно. HIFα димеризуется со своим конститутивным связывающим партнером HIF-1β (также известным как ARNT) и транслоцируется в ядро, одновременно трансактивируя множество таргетных генов, содержащих HRE, которые, как считается, включают ≈1-10% транскриптома человека. 2. Умеренная гипоксия инициирует ROS и АТФ→АМФ-зависимое ингибирование mTOR комплекса, что в свою очередь блокирует трансляцию протеинов. 3. Тяжелая гипоксия (<0,1%) индуцирует аккумуляцию мисфолдинговых протеинов в ER, приводя к активации UPR, вторичной к IRE-1-зависимому сплайсингу транскрипционного фактора XBP1, одновременно стимулируя PERK kinase-инициируемое ингибирование трансляции, при этом селективно транслируя ATF4-зависимые таргетные гены, которые в конечном итоге останавливают потребление АТФ за счет кэп-зависимой трансляции и повышенной транскрипции/трансляции генов ER, направленных на восстановление протеинового гомеостаза. Кроме того, тяжелая гипоксия ингибирует cap-зависимую трансляцию благодаря 4ET-зависимой ядерной секвестрации eIF4E [145]. Гипоксия-индуцибельные механизмы показаны синим цветом, негипоксические механизмы изображены красным. Пунктирные стрелки указывают на ингибирование. Аббревиатуры: 4EBP — eukaryotic translation initiation factor 4E binding protein; 4ET — eukaryotic translation initiation factor 4E transporter; AMPK — AMP-активированная протеинкиназа; ATF4 — activating transcription factor 4; BNIP3 — BCL2/adenovirus E1B 19-kDa protein-interacting protein-3; CBP — CREB-связывающий протеин (также известный как KAT3A); eEF2 — eukaryotic elongation factor 2; eEF2K — eukaryotic elongation factor-2 kinase; eIF2 — eukaryotic translation initiation factor-2; eIF4A, 4E, 4F, 4G — eukaryotic translation initiation factor-4A, -4E, -4F, -4G; ER, endoplasmic reticulum; FIH1, factor inhibiting HIF (также известный как HIF1αN); HIF, гипоксия-индуцибельный фактор; HRE, гипоксия-отвечающие элементы; IRE1, inositol-requiring enzyme 1 (также известный как ERN1); mTOR, mechanistic target of rapamycin; p300, E1A-связывающий протеин (также известный как KAT3B); p70S6K, ribosomal protein S6 kinase beta 1; PERK, protein kinase RNA-like endoplasmic reticulum kinase (также известная как EIF2AK3); PHDs, prolyl-4-hydroxylases; PML, promyelocytic leukemia oncogene; Pol II, RNA polymerase II; pVHL, Von Hippel-Lindau опухоль-супрессорный протеин; REDD1, regulated in development and DNA damage responses 1 (также известный как DDIT4); Rheb, Ras homolog enriched in brain; ROS, активные формы кислорода; S6, рибосомальный протеин S6; TSC1 or 2, tuberous sclerosis 1 or 2 protein;; UPR, unfolded protein response; XBP1, X-box binding protein 1 (XBP1s, spliced).
Гипоксия и лимфатический гомеостаз
Анатомическая конфигурация лимфатической сети как «терминальной» системы, контролирующей состав интерстициальной жидкости, ее объем и иммунологические взаимодействия (вставка 2), результирует в микросреду с более низким уровнем O2, чем в дренируемой ткани [20]. В частности, лимфатическая гипоксия возникает в результате взаимодействия между (i) поставкой O2, обеспечиваемой кровеносными сосудами ткани/органа-мишени (т. е. перфузией); (ii) паренхиматозными уровнями О2, детерминированными микроваскулярной плотностью; и (iii) потреблением O2 (т. е. метаболической активностью) пери- или интралюминальными клетками, включая лимфатические эндотелиальные клетки (LEC), нодальные или экстранодальные лимфоциты, антиген-презентирующие клетки (APC) и гладкомышечные клетки в преколлекторных/коллекторных лимфатических сосудах. В контексте рака на локальный лимфатический О2 также влияет пространственное распределение СС, поскольку они располагаются нерегулярно в геометрии лимфатической (и кровеносной) сосудистой сети, таким образом детерминируя расстояния диффузии [20, 21, 22, 23, 24, 25, 26, 27, 28, 29]. Микроваскулярные измерения в лимфе показывают средние уровни O2 ≈4,9%, достигая значений всего 0,11 ± 0,03% (почти аноксия) в «слепых» начальных лимфатических сосудах, расположенных на расстоянии > 100 мкм от ближайшего кровеносного сосуда (Таблица 1) [21]. LEC, изолированные из гипоксических начальных лимфатических сосудов кожи человека или более оксигенированных коллекторных лимфатических сосудов, оптимально пролиферируют in vitro только при культивировании в условиях, когда уровни O2 имитируют их нативную микросреду [30]. Гипоксические LEC активируют программу повышения гликолитического метаболизма, перестройки внеклеточного матрикса, пролиферации, адгезии, апоптоза, окислительного стресса, иммунитета и перестройки лимфатических сосудов [31, 32, 33]. Кроме того, гипоксические LEC полагаются на транскрипционную активность гипоксия-индуцибельного фактора-1α (HIF-1α)-C/EBP-δ для миграции и организации в трехмерные лимфоваскулярные сети in vitro [34].
Продолжение следует