Tweek создал и поддерживает сайт; цель — освещение вопросов молекулярной (молекулярной биологии) онкологии
14.03.2023
Материалы размещаются в группах ВКонтакте и Телеграм (в последнем только часть)
ЭНДОКРИННЫЕ ГИПЕРПЛАЗИИ ВСЕ-ТАКИ РАК?
Вопрос длительно «висел» в Российском медицинском сообществе и по умолчанию предполагалось, что гиперплазия в эндокринологии — это следствие, например, падения входящего сигнала или разрыва обратной связи или др.бяки. То есть она — компенсаторный вариант, то есть вариант нормы. Вопрос возник вследствие оценки макронодулярной гиперплазии надпочечников — енто что и может ли «енто» быть следствием эпигенетических механизмов? Нет, не может, поскольку эпигенетика селективна для клеток, и , во-вторых, максимум наследуется 1 поколением. «Компенсаторный вариант и вариант нормы» — это гипертрофия. А написав слово гиплазия в истории болезни вы пишите рак (неоплазию, опухоль, канцер, карциному и тд, суть остается неизменной). Организм защищен он «нормального количества клеток + 1», в частности контактным ингибированием. И если онкологи не лезли в дела эндокринологов, «каждый занимается своим», то их вынудили. Проспали главное, и проспали не только в нашей стране, но и в Америке с такими же тупыми профессорами и академиками, как и в нашей стране (не все, конечно). Не нужно ориентироваться на Америку, и передирать клинические рекомендации с их guidelines, последние, как правило, имеют большие ошибки
ТЕЗИСЫ, КОТОРЫЕ ПРОТИВОРЕЧАТ ДОГМАМ МЕТАСТАЗИРОВАНИЯ
28.09.2023
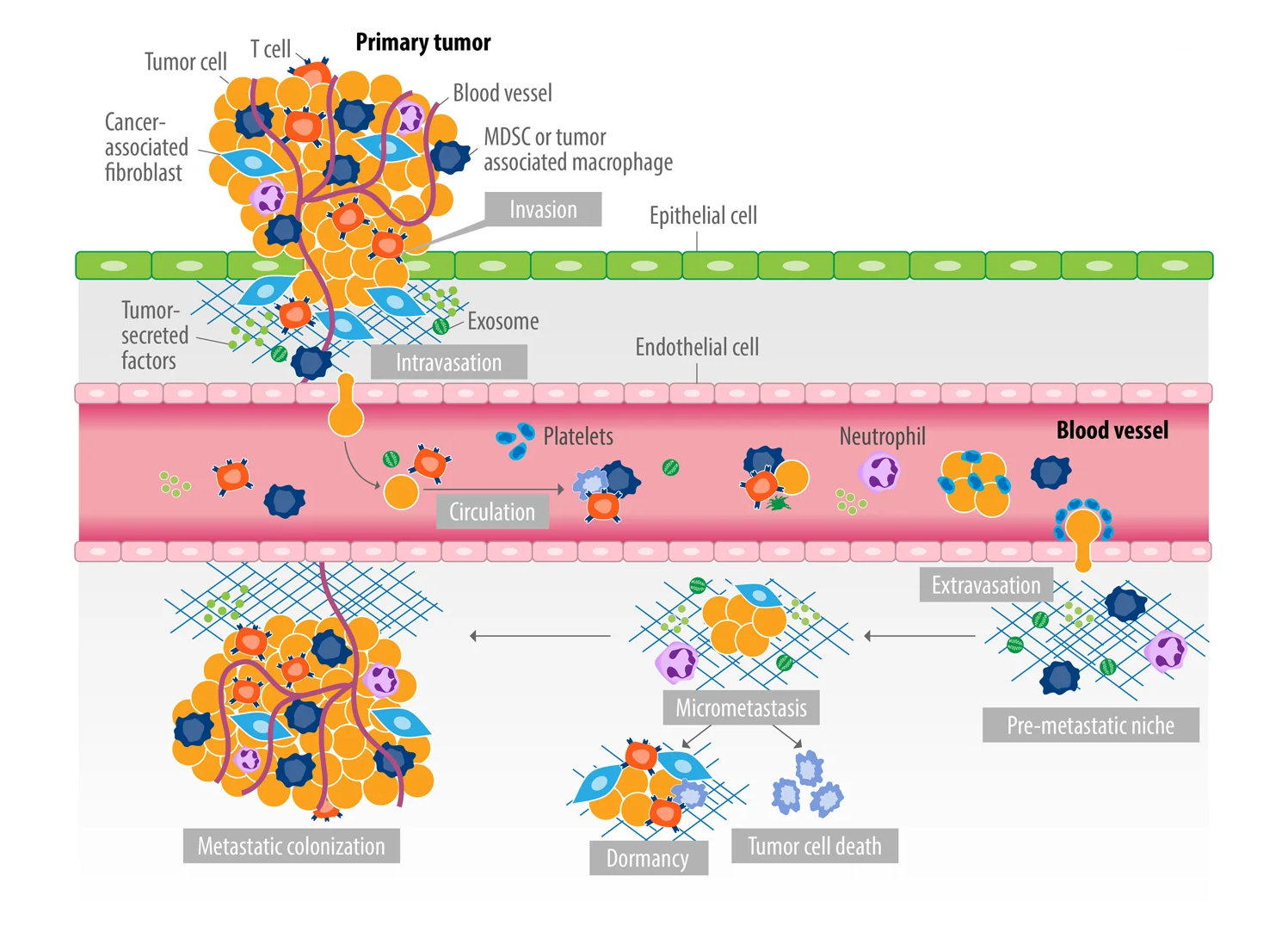
- TNM неудачная классификация для рака, которая полагается на предположение раннего вовлечения лимфоузлов N (node) в метастастатический процесс. Опухоль типично метастазирует гематогенным путем и редко лимфогенно. Третий путь – метастазирование интраневрально
- Нет строгой последовательности метастазов. Они могут происходить как: первичная опухоль в метастаз (отдаленный сайт), метастаз в метастаз, метастаз в первичную опухоль
- Метастазирование наблюдается раньше прорастания сосудов в опухоль или инвазии рака в сосуд. Раковые клетки перемещаются в ткани к сосудам как одиночные клетки, так и в виде клеточных кластеров.
- Последние могут включать фибробласты и макрофаги и формируют дорвеи на границе ткань-просвет сосуда, которые «пропускают» через себя много метастазирующих клеток.
- Предполагается, что именно кластеры циркулирующих опухолевых клеток (CTC) ответственны за большинство метастазов, которые защищают CTC от анаикоса (интегрин-зависимая форма интринсингового апоптоза) межклеточными контактами. Они способны проходить через капилляры, вытягиваясь, но сохраняя связь через межклеточные контакты
- Гипоксия и трансформирующий фактор роста бета – универсальные промотеры метастазирования, благодаря индукции эпителиально-мезенхимального транзита
- Эпителиально-мезенхимальный транзит полностью не объясняет движение раковых клеток в сторону метастазов
ЭВОЛЮЦИЯ НАШЕГО ПОНИМАНИЯ РАКА
08.09.2023
Рак – сложное образование, включающего раковые клетки, которые могут находится в переходных статусах между эпителиальным и мезенхимальным, и клетки хозяина. То есть все клетки хозяина (за исключением гладких мышц) в месте развившегося рака, включая иммунные клетки, также являются опухолевыми (опухоль-промотирующими, более точно).
Изначально предполагалось, что рак может инициировать единственная случайно возникшая раковая клетка, которая «утратила» 2 аллеля критического протеина, связанного с клеточным циклом или репарацией ДНК. По мере нарастания количества мутаций (мутации в системе восстановления ДНК) эта клетка продуцирует клоны, отличающиеся по мутациям.
Действительно, раковые клетки весьма гетерогенны и биопсии опухоли с одного края опухоли могут продемонстрировать мутации, почти полностью отличающиеся от биоптатов с другой стороны. Эта гипотеза подтверждалась многочисленным экспериментальным материалом и онкологи в 90-х годов с облегчением выдохноли: проблема рака скоро будет закрыта. Неукладывалась в сознание несколько деталей: фактически «убив» всю опухоль, она рецидивировала спустя время; полностью удалив первичную опухоль через 20 лет возникал метастаз; количество мутаций в раковой клетке равнялось количеству мутаций в здоровой соматической клетке. «А как же генетическая нестабильность и опухолевая клональность», – заныли онкологи.
Начались поиски неуловимых клеток, которые согласно экспериментам обладали, как минимум, 2 характеристиками стволовостью и бесконечным репликативным потенциалом. Эти же характеристики присущи стволовым клеткам. Поэтому не мудрствуя лукаво, клетки обозначили как раковые стволовые клетки (CSC), но только назвали, что они на самом деле представляют и откуда берутся неясно до сих пор. Полагаясь на представления, что помимо стволовых клеток в организме нет ничего подобного, а инволюция из дифференцированной клетки обратно в стволовую невозможна в принципе, первоначально декларировалось, что мутации тканевой стволовой (исправлено) клетки и ведут к возникновению раковой стволовой клетки. Кричали онкологи: ура! И в воздух чепчики бросали. Нужно убить только CSC, а остальные раковые клетки сами сдохнут, что и подтверждалось отсутствием активности теломераз (фермент, наращивающий гегсануклеотид TTTGGA на концах теломер, что поддерживает их длину и позволяет клеткам входить в клеточный цикл) в подавляющем большинстиве раковых клеток. Не понятно было, как (раковая) стволовая клетка, которая очень редко делится, способна за короткое время продуцировать большую опухоль.
Пока ломали голову, открытие коктейля Яманаки сломало картину маслом: возможна инволюция, то есть из любой дифференцированной соматической клетки можно получить стволовую, активируя определенный набор транскрипционных факторов. Таким образом выходило, что нужно эрадицировать все клетки, и стволовые и соматические раковые. Например, старение-ассоциированный секреторный фенотип может инициировать формирование CSC, таким образом лечение путем опухолевого состаривания вело к противоположным результатам.
Одновременные работы, посвященные метастазированию результировали в открытие, что клетка может еще и поменять фенотип на раз-два. Эпителиальные клетки, формирующие опухоли, способны переключаться на мезенхимальный фенотип, приобретать мобильность, избегать аноикиса, и распространяться по всему организму, например, в результате гипоксии, которая присутствует в любой опухоли. Зашаталась почва под другим направлением: в попытках блокировать кровоток к опухоли, мы превращаем ее в более агрессивную и метастатическую. Но эпителиально-мезенхимальным транзитом не объясняются все типы фенотипической пластичности опухоли, это открытый вопрос.
Опухоль в процессе роста изменяет враждебную среду хозяина, которая начинает «обслуживать» опухоль. Введен термин «опухолевая микросреда», включающая фибробласты, эндотелиальные клетки сосудов и тд (всё, кроме гладкомышечных клеток). Одних геномных мутаций (и, вероятно, проканцерных эпигенетических изменений) недостаточно для формирования опухолей. Это другой открытый вопрос.
До чего дошёл прогресс, до невиданных чудес… пока известно мало. Есть важные мелочи, возможно опишу в других блогах, которые помогут орентироваться в состоянии неопределенности. Возможно будет доступна чиповая диагностика, но на нее нужны деньги, то есть весь хлам общих анализов на помойку, биохимию и так далее, MRI, CT – туда же. То что вы видите на образных исследованиях (MRI, CT), это констатация факта, она не позволяет сделать выводов о направленности процессов. Визализация метастазов на MRI, например, – это уже приговор для пациента, а не «появление метастазов», как считают «светилы» отечественной онкологии, поскольку начался их быстрый рост после продолжительного молчания – дормантности.
ЗАКОНОМЕРНОСТЬ БОЛЕЗНЕЙ
20.08.2023
Болезни человека — закономерное явление. Они прописаны в генетическом или эпигенетическом коде, в генах, некодирующих рибонукленовых кислотах, метилировании/деметилировании промотеров генов и изменении гистоновых протеинов (об этом напишу позже). Это высоко контролируемые события, исключающие случайность. Глобально, средовое влияние ничтожно и им можно пренебречь (но это не применимо к микросреде). Даже травмы и инфекционные болезни имеют бэкграунд. Простые патологические процессы развиваются по одинаковым законам: дефолдинг протеинов, воспаление и пр., сложные, например, рак, являются разнообразной комбинацией простых. Доля случайности стремиться к нулю. Психосоматика — это фантастика, и кто всерьез занимается медициной при слове «психосоматика» покрутит у виска. Поиск болезней путем скрининга — это офигенно глупая штука, деньги на ветер. Биохимический анализ крови, тем более общий анализ крови и мочи — пустота, они не оправдывают средств, выделяемых на болезни. Эти деньги можно использовать на поиск эпигенетических маркеров болезней. Болезни обладают эпигенетическими маркерами, уникальная комбинация последних может верифицировать нозологическую форму. 16 числа послушал лекцию по гепатоцеллюлярной карциноме (и метастазам CRC в печень — правка) от лектора из института Герцена. После пары вопросов лекция была прервана и лектор будет заменен по причине его не готовности. Уверен, проку от второго лектора также не будет. Онкологи (включая академиков и профессоров) воспринимают рак и метастазы, как случайные процессы. Метастазы появляются на раннем этапе в виде дормантных клеток, это полноценные раковые клетки, но неделящиеся, возможно не прошедшие мезенхимально-эпителиальный транзит, возможно находящиеся в суровых условиях чужеродной микросреды, ограничивающих их деление, пока они не создадут собственную метастаз-промотирующую микросреду. Когда они видны на образных обследованиях, значит они вышли из дормантности и спасать пациента, как правило, бесполезно. Существует термин «оккультные метастазы», привязанный к образным исследованиям. Этот термин лучше совсем забыть. Все метастазы – изначально оккультные. Когда вы выявляете рак, считайте, что метастазы уже есть. Не нужно проводить жидкую биопсию, последняя всегда положительна. Это экономит время и деньги. Выполните PCR и спасете жизнь. Но согласно институту Герцена метастазы появляются неожиданно уже в виде «семян». Все вышесказанное применимо к другим болезням, а рак использован, как пример, закономерности всех болезней. Поэтому удивляешься диспансеризации, под которую выделены деньги и которые с..(освоят), удивляешься сбору всех анализов у пациентов, удивляешься санаторно-курортому лечению, удивляешься, когда госпитализируют пациента для наблюдения и так далее. 99% современной медицины – это пустота, врачи приходят на работу, чтобы имитировать работу. Посмотрел спор вокруг острого живота, все предлагают сделать общий анализ крови. Вам зачем? Что вы хотите в нем найти? Лейкоцитоз и сдвиг лейкоцитарной формулы будет в 100% случаев. На Магазаника подписано больше всех человек! Вы с ума сошли, вам времени не жалко? Его уровень — 1-2 курса медунивера, причем зачастую с неправильной интерпретацией фактов. Пост написан под влиянием публикации, связавшей вакцинацию со снижением болезни Альцгеймера. Сидели врачи вокруг пациентов с б. Альцгеймера много лет и вдруг сделали дурацкий вывод: вакцинация таки снижает болезнь. Это абсурд, нет ни одного нормального исследования, позволяющего сделать подобные выводы, скорее вакцинация усилит и ускорит протекание болезни. Но выводы были сделаны и напечатаны. В онкологии подобные исследования перестали проводить, как бесполезные и не позволяющие сделать никаких более-менее важных выводов. Максимум через 10 лет будет сделан NGS всех людей и будут известны текущие и будущие болезни, и создана база с использованием ИИ. Через 10 лет врачи будут не нужны, зачем открывают новые медвузы?
PS. Для тех, кто дочитал: эпигенетический код меняется в течение жизни, поэтому «программирование» перманентно меняется, но никто не обратил внимания, и это очень плохо, медицина «протухла» и лучше ИИ, чем врачи
ПОЧЕМУ В РОССИИ НИКОГДА НЕ БУДЕТ МЕДИЦИНЫ (ДАЖЕ ПЛОХОЙ)
30.06.2023
В 60-х годах прошлого века историк науки и философ Thomas Samuel Kuhn писал: «мышление определяется «парадигмами» или концептуальными мировоззрениями, состоящими из формальных теорий, классических экспериментов и проверенных методов. Ученые обычно принимают господствующую парадигму и пытаются расширить ее границы, уточняя теории, объясняя загадочные данные и устанавливая более точные измерения стандартов и явлений».
Типичный врач — это пассажир в поезде, мимо которого пролетают картинки за окном в виде «заболеваний», он проводит сличение этих картинок с оригиналом и перебирает возможные диагнозы. Подобие клоуна доктора Хауса из одноименного сериала, вся работа которого сводилась к генерации бессчетного количества бессмысленных диагнозов и их проверке/подтверждению. Врач не задается вопросом, что лежит в основе заболевания, что, например, патогенез и лечение фиброза ткани и рака во многом схожи и определяются эпителиально-мезенхимальным транзитом, который необходим для миграции клеток в течение эмбрионального развития. Это нормальный процесс, не соответствующий времени и обстоятельствам. Болезни были изначально описаны по клиническим проявлениям, а не по процессам, лежащим в их основе. По мере изучения патологических процессов (в котором большое безучастие и пофигизм принимали отечественные врачи) болезни были разделены на субкатегории: клеточная смерть (случайная и неслучайная — аутозис, ферроптоз, аутофагия-зависимая смерть, анойкис, апоптоз, некроптоз, всего около дюжины), аутофагия, стресс эндоплазматического ретикулума, воспаление, клеточная пролиферация и пр. Болезни разных систем сравнялись, отличались индукторы. Соответственно, отпала надобность делить врачей на неврологов, гастроэнтерологов и так далее. Все болезни свелись к взаимодействующим между собой эукариотическим клеткам. Сегодня добавляют дополнительный орган — кишечных прокариотов (микробиоты), но если всех, то почему не из других систем (кожи, GI и пр.).
В медицинских университетах в нас закладывают базис медицины, основанный на неадекватных представлениях. Единичными предметами, которые соответствуют сегодняшней парадигме, являются биофизика, биохимия, анатомия, изученные вдоль и поперек и в которых нет ошибок. Все остальные учебники лживы.
Пару слов о парадигме: Научная парадигма — это основа (более точно framework), содержащая все общепринятые взгляды на предмет, соглашения о том, в каком направлении следует проводить исследования и как их следует проводить. Термин ввел Thomas Kuhn в книге «The Structure of Scientific Revolution», опубликованной в 1962 году.
До середины прошлого века в методологии науки доминировала парадигма Поппера (Karl Popper): генерация гипотезы и проверка их на опыте. Это мы и наблюдаем в медицинской науке в России, где профессора мало понимая в медицине (поинтересуйтесь у Магазаника, Мельниченко методологией сегодняшних экспериментов, будут смотреть на вас, как баран на новые ворота), неспособны объяснить молодым ученым методологию предмета и перспективы. В 60-х годах Попперовская парадигма сменилось Кюновской, при которой происходила аккумуляция научных знаний, и если последние не соответствовали текущей научной парадигме и достигали критической массы, учебники переписывались заново.
Сегодня мы имеем новую парадигму Imre Lakatos. Методология Lakatos: во-первых, жесткие базовые предположения, что означает, что они являются общими для группы теорий, а во-вторых, защитный пояс вспомогательной гипотезы означает, что они актуальны только в конкретном исследовательском программировании. Наконец, положительная и отрицательная эвристика, в которой положительная эвристика означает способ организации исследования, то, как мы используем нашу переменную, а затем то, как наше исследование предназначено для проверки вспомогательных предположений. В лакатосианской MSRP твердое предположение защищено от прямой эмпирической проверки набором методологических запретов.
Упрощенно: проводятся эксперименты, в которых либо подтверждается, либо опровергается факт.
Некоторые выводы: в медицине, в целом, все известно, научных революций не будет, будут проверяться частности, которые важны. Тем не менее существуют чудики, которые предлагают новые законы медицины. Фактически все врачи не интересуются биологией заболеваний, то есть являются лузерами. Есть медицинские знания и отдельно от них врачи, при этом врачи продолжают работать.
ОСНОВА МЕДИЦИНЫ — КЛЕТКА
13.05.2023
Любая наука строится на своде правил/концепций. В медицине – их нет. Не может существовать наука без подобных правил. Существует биохимия, биология, физиология и пр. базисные науки, едва пересекающиеся, описывающие часть процессов, единой концепции нет. Попытки выйти за пределы клетки (мне известные) в поисках законов жизни как «состояния, отличающее животных и растения от неорганической материи, включая способность к росту, размножению, функциональной активности и непрерывным изменениям, предшествующим смерти» ничем не увенчались. Сознание трудно рассматривать в контексте клетки. Но если трактовать сознание как построение внутренней картины мира, задача сильно упрощается. Внутреннюю картину мира может выстроить и таракан с его нервным ганглием вместо головного мозга. Тогда организм человека представляет взаимозависимую совокупность органов, органы – это 3D ткани, ткань — набор взаимосвязанных клеток (точнее клеток и внеклеточного матрикса). То есть клетка – основа существования человека, ее и нужно изучать, не хрень, подобную физиологии и пропедевтике. Клетка происхождения (и существования) ткани (тканевая стволовая клетка) – обособленная в пространстве единица, заполненная морской водой (привет дивергентной эволюции) и отгороженная от внеклеточного пространства (самоорганизующимися в воде) жировыми мембранами. Таким образом, мы полностью обходим галиматью с уровнями организации материи. Стволовая клетка может находится в двух статусах – активации и покоя. Дальше не совсем понятно: может ли она находится в зависимости от характера среды в 3 фенотипах (то есть иметь начальную степень дифференцировки и отличительные маркеры) — эпителиальном, мезенхимальном и эндотелиальном — или эти маркеры характеризуют ранние прогениторы? Как бы то ни было, между фенотипами стволовая клетка перемещается во времени (условно, нулевой статус по оси дифференцирования) благодаря индуцирующим внешним сигналам. Активные фенотипы могут дифференцироваться по оси: ранние прогениторы, поздние прогениторы и дифференцированные клетки, так же как дифференцированные клетки могут дедифференцироваться обратно в нулевой статус (то есть у взрослых процесс – двунаправленный). Эта система не стабильна (в то время как в высшей школе навязывают — стабильна) и легко изменяется!
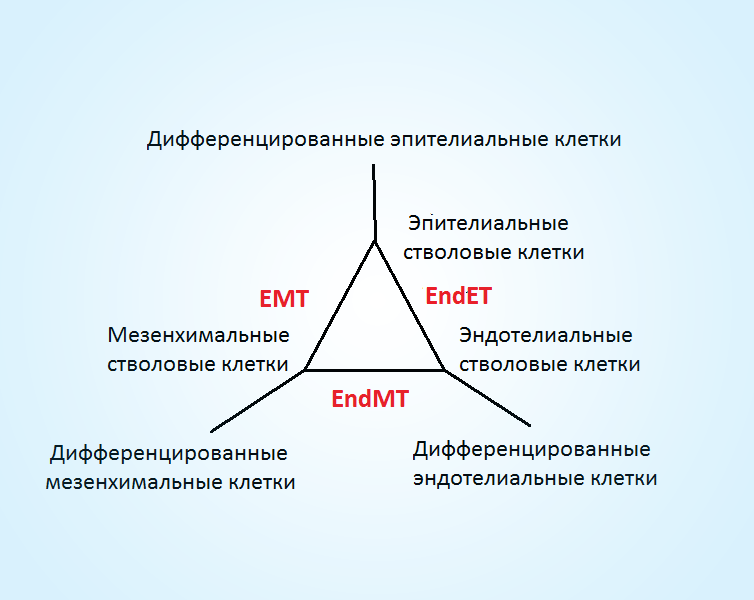
Между этими 3 крайностями существует много переходных состояний: эпителиально-мезенхимальный транзит (EMT) и его противоположность (MET), эндотелиально-мезенхимальный транзит (EndMT) и его противоположность (MEndT), эндотелиально-эпителиальный транзит (EndMT) и его противоположность. Основа патологии человека – это не соответствующие месту и времени транзиты между фенотипами клеток. По-сути, клетка представляет отгороженные и сгруппированные (благодаря мембранам — внешней плазматической, эндоплазматической, митохондриальной и ядерной) биохимические процессы. Все это очень близко к формулировке «жизни [как] способа существования белковых тел (протеинов), существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причём с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка-стрелка (протеина)». Набор биохимических программ – это интринсиговые свойства клетки на определенный момент, благодаря которым она потенциально способна создать сообщества. Экстринсиговые свойства (кодируются геномом данной клетки) — непрерывный обмен между клетками (включая отдаленные области) нуклеиновыми, протеиновыми, липидными, углеводными соединениями, запакованные в «конверты», внеклеточные везикулы и изменение программ (частично кодируются геномом данной клетки). Существует также другие способы обмена – паракринный, эндокринный и механический, которые играют вспомогательную роль в межклеточных коммуникациях. Внеклеточные везикулы – перепрограммирование клеток (смена клеточных поцессов), гормоны, цитокины, факторы роста – тонкая настройка по типу «больше-меньше» этих поцессов. Последние вследствие своей простоты «субстанция-когнантный рецептор» были выделены и определены раньше и они положены в современную модель регуляции человека. Нынешняя модель «клетка с устойчивым функционалом-вспомогательные средства коммуникации» сильно отличается от предложенной «клетка с динамическим функционалом -внеклеточный матрикс-основные и вспомогательные средства коммуникации». Собрать информацию о работе организма (или по болезни) можно по внеклеточным везикулам, но не по факторам роста, цитокинам, метаболическим интермедиантам и гормонам (тем более плазмы), за исключением нескольких случаев мутации генов, кодирующих важные мессенжи или их трансдукторные пути, например, инсулин. То есть конвекциональная медицина с ее набором обманок – большое надувательство
ИЗМЕНЕНИЯ НЕКОТОРЫХ ОСНОВ ТУМОРОГЕНЕЗА И РАКА
16.03.2023
Рак – пролиферативное заболевание. Он инициируется и поддерживается раковыми стволовыми клетками (или рак/опухоль-инициирующими клетками) (cancer stem cells, CSC). Нужно отменить, что клетка – это элементраная единица человека, она может менять свой фенотип при инициировании набора генетических программ во взрослом состоянии, то есть переходить из эпителиального статуса в мезенхимальный или в эндотелиальный статус или из мезенхимального в эпителиальный (трансдифференцирование), что казалось немыслимым пару лет назад, и это говорит нам о том, что научные парадигмы, закладываемые нас в университетах – были ошибочны. Эти свойства используются раком. Раковая стволовая клетка обязательно обладает стволовостью, то есть самоподдержанием и генерацией дифференцированного потомства благодаря ассиметричному делению. Стволовость отличает CSC от всех других клеток организма и роднит с тканевой стволовой клеткой. Раковая стволовая клетка обладает ошибочными транскрипционными программами, главной (но не единственной) является бесконечный вход в клеточный цикл. Транскриптомные программы детерминируются как мутациями в онкогенах, опухоль-супрессорных генах и генах стабилизации, так и адаптивными изменениями к неблагоприятной внешней среде (опухолевой микросреде) раковых клеток. CSC редко делится, поэтому основную массу опухолевых клеток продуцируют ранние прогениторы CSC. Гипотетично CSC могут происходить из тканевых стволовых клеток, из дифференцированных (соматических) раковых клеток путем дедифференцирования или из других источников, учитывая что клетка – всего лишь единица, являющаяся дериватом внешних условий. Например, стареющие раковые клетки индуцируют старение-ассоциированный секреторный фенотип, секретирующих ключи для дедифференциации ракомых клеток в CSC.
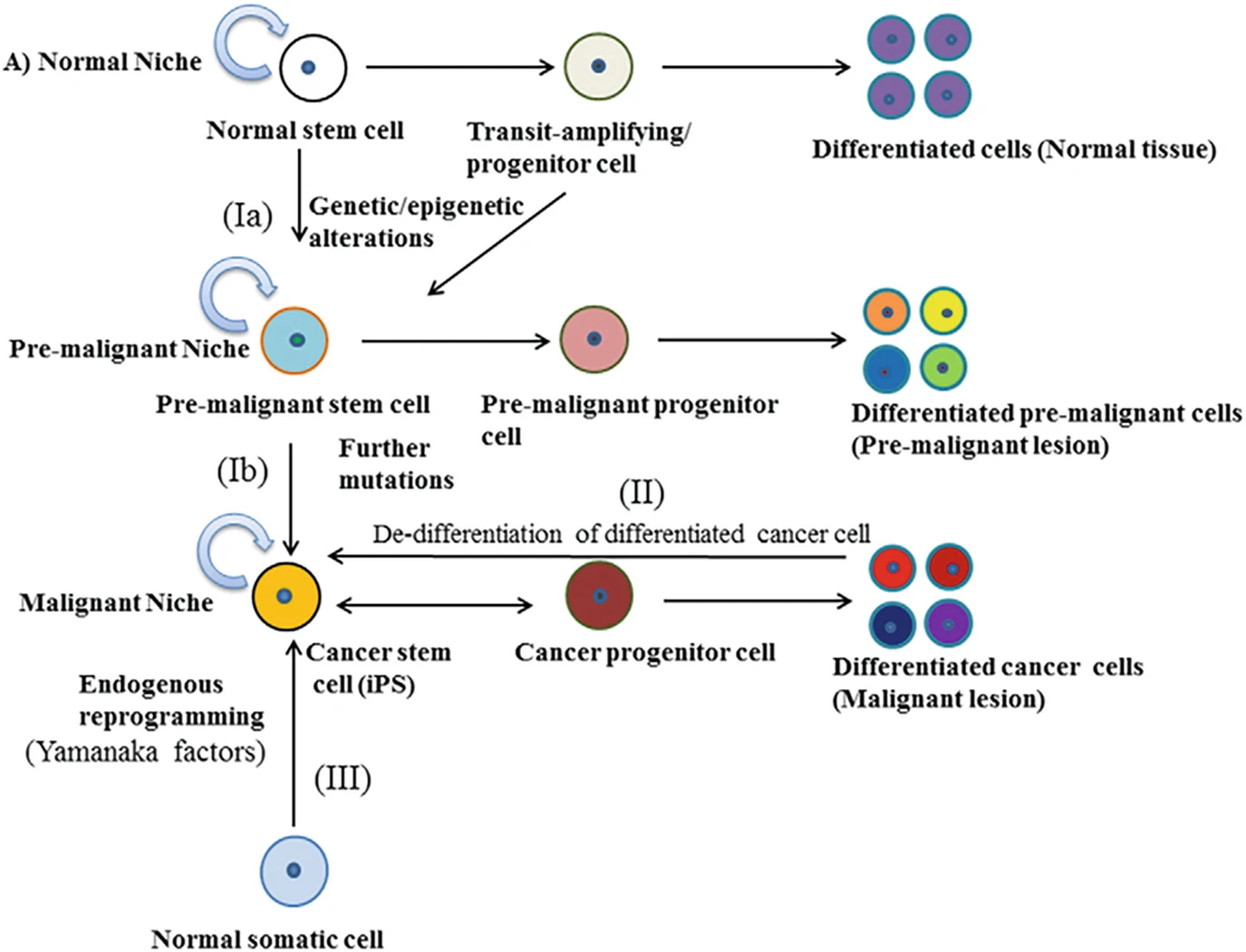
Генерация раковых стволовых клеток. Изменения в стволовых или прогениторных клетках приводят к дерегулированной клеточной продукции с различной степенью аберраций и утрате многих признаков нормальных клеток, тем самым вызывая предраковые поражения во время многоэтапного патогенеза рака. При аккумуляци дальнейших мутаций предраковые стволовые клетки могут превращаться в раковые стволовые клетки (гипотеза I). Раковые стволовые клетки могут продуцировать раковые прогениторные клетки и могут генерировать различные субпопуляции раковых клеток. Кроме того, дифференцированные раковые клетки могут приобретать самообновление, а также свойства раковых стволовых клеток дедифференцированием (гипотеза 2). Нормальные соматические клетки могут конвертироваться в раковые стволовые клетки клеточным перепрограммированием: индуцированной экспрессии транскрипционных факторов (факторов Яманаки) (гипотеза 3).
Вторым ошибочным было предположение, что все раковые клетки бессметны (иммортализованы) благодаря работе фермента теломеразы, наращивающую на концах ДНК и теряемую в каждом цикле гексануклеодидную последовательность TTTGGA. На ранних стадиях рака, раковые клетки большинства клонов терминально дифференцируются. На поздних стадиях рака действительно появляются иммортализованные раковые клетки ввиду геномной нестабильности, но не они уже играют первую роль в развитии рака. Раковые дифференцированные клетки могут также дедифференцироваться, формируя пул заново появившихся CSC.
На начальных этапах рак продвигается мутациями. Затем формируется опухолевая микросреда, которая промотирует рост опухоли. Поэтому блокирование сигнальных путей, измененных мутациями, в большинстве распространенных карцином неэффективно. Опухолевая среда — это клетки гетерогенных раковых клонов, разнообразные инфильтрирующие иммунные клетки, канцер-ассоциированные фибробласты и пр., которая является вторым драйвером опухолевого развития. Опухолевая микросреда всегда гипоксична, поскольки раковые клетки пролиферируют, отдаляясь от сосудов, активно конкурируют за нутриенты и кислород с другими клетками, используя, например, прямой и обратный эффект Варбурга, то есть нормальные клетки, включая иммунные клетки, инфильтрирующие опухоли и элиминирующие раковые клетки, заведомо проигрывают соперничество раковым. Опухолевая гипоксия – третий драйвер опухолевого развития. Гипоксия объясняет неэффективность противоопухолевых препаратов, лучевой терапии и фотодинамической терапии в распространенных опухолях. Например, антиангиогенные препараты могут дополнительно способствовать опухолевой гипоксии, радиотерапия и фотодинамическая терапия малоэффективны в гипоксической опухолевой среде поскольку используют кислородные радикалы и фиксацию кислорода в основе своего действия. Кроме того излишняя депозиция внеклеточного матрикса, продуцируемого канцер-ассоциированными фибробластами в условиях гипоксии, создает препятствия для пенетрации в опухоль противоопухолевых иммунных клеток, и, с другой стороны, диффузии нутриентов и кислорода вглубь опухоли. Гипоксия промотирует иммуносупрессию, эпителиально-мезенхимальный транзит и метастазирование, опухолевую гетерогенность, нарушение репарации ДНК среди прочих и, в конечном итоге, отбирает агрессивные клоны.