Опухолевая оксигенация
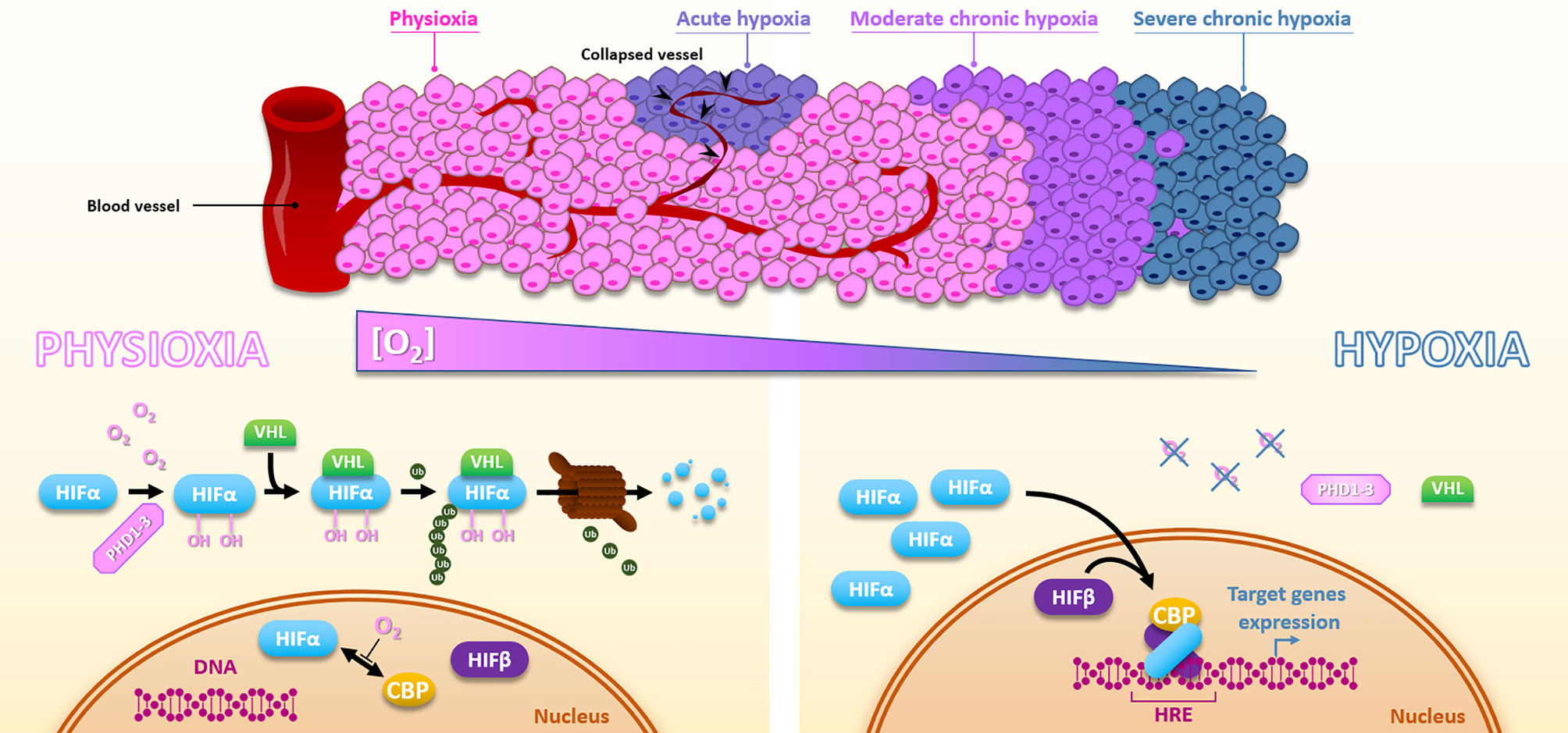
В последние два десятилетия гипоксия была предложена в качестве нового характерного признака рака, имеющего существенное клиническое значение [1–3], поскольку она оказывает сильное влияние на паттерны экспрессии генов и может приводить к усилению геномной нестабильности и возникновению мутаций. Большинство гипоксия-драйверных изменений в экспрессии генов вызваны активацией гипоксия-индуцибельных факторов (HIF). HIF-α являются ключевыми транскрипционными фактороми, играющими многогранную роль в обеспечении, среди прочего, преимуществ выживания опухолевых клеток, поддержания стволовости раковых клеток, стимулировании опухоль-промотирующих ответов, резистентности к последствиям кислородной (O2) и нутриентной депривации, что результирует в более злокачественный фенотип [4]. HIF-индуцированная адаптация также включает метаболическое перепрограммирование и аденозин-опосредованное ослабление противоопухолевых иммунных ответов [5].
Гипоксия также адверзивно влияет на ответы опухолевых клеток на стандартную лучевую терапию, некоторые формы химиотерапии, фотодинамическую терапию и противоопухолевую иммунотерапию. Все вышеперечисленные процессы могут промотировать злокачественное прогрессирование, т. е. более агрессивный характер роста, повышенную склонность к локальным рецидивам и метастазированию. По этим причинам гипоксия сильно коррелирует с неблагоприятным прогнозом для пациентов [2], из чего следует ее мониторинг при постановке диагноза и в течение курса лечения.
Исследования роли диффузия-ограниченной гипоксии в лечебном ответе опухолей насчитывают более 60 лет [6]. После введения маркеров экзогенной гипоксии и позитронно-эмиссионной томографии (PET [7]) и рО2-гистографии для прямого измерения рО2 [8] стала возможной систематическая оценка статуса опухолевой оксигенации и детекция опухолевой гипоксии в клинических условиях. Клиническое использование этих методов обнаружения гипоксии проводилось параллельно с открытием и характеристикой HIF [9].
http://malignancy.ru/oxygenation-of-tumors/
Литература:
- Vaupel P, Mayer A, Hцckel M (2004) Tumor hypoxia and malignant progression. Methods Enzymol 381:335–354
- Vaupel P, Mayer A (2007) Hypoxia in cancer: significance and impact on clinical outcome. Cancer Metastasis Rev 26(2):225–239
- Ruan K, Song G, Ouyang G (2009) Role of hypoxia in the hallmarks of human cancer. J Cell Biochem 107(6):1053–1062
- Mayer A, Vaupel P (2013) Hypoxia, lactate accumulation, and acidosis: siblings or accomplices driving tumor progression and resistance to therapy? Adv Exp Med Biol 789:203–209
- Vaupel P, Mayer A (2016) Hypoxia-driven adenosine accumulation: a crucial microenvironmental factor promoting tumor progression. Adv Exp Med Biol 876:177–183
- Thomlinson RH, Gray LH (1955) The histological structure of some human lung cancers and the possible implications for radiotherapy. Br J Cancer 9(4):539–549
- Koh WJ, Rasey JS, Evans ML et al (1992) Imaging of hypoxia in human tumors with [F-18] fluoromisonidazole. Int J Radiat Oncol Biol Phys 22(1):199–212
- Vaupel P, Schlenger K, Knoop C et al (1991) Oxygenation of human tumors: evaluation of tissue oxygen distribution in breast cancers by computerized O2 tension measurements. Cancer Res 51(12):3316–3322
- Wang GL, Semenza GL (1993) Characterization of hypoxia-inducible factor 1 and regulation of DNA binding activity by hypoxia. J Biol Chem 268(29):21513–21518



I don’t think the title of your article matches the content lol. Just kidding, mainly because I had some doubts after reading the article.