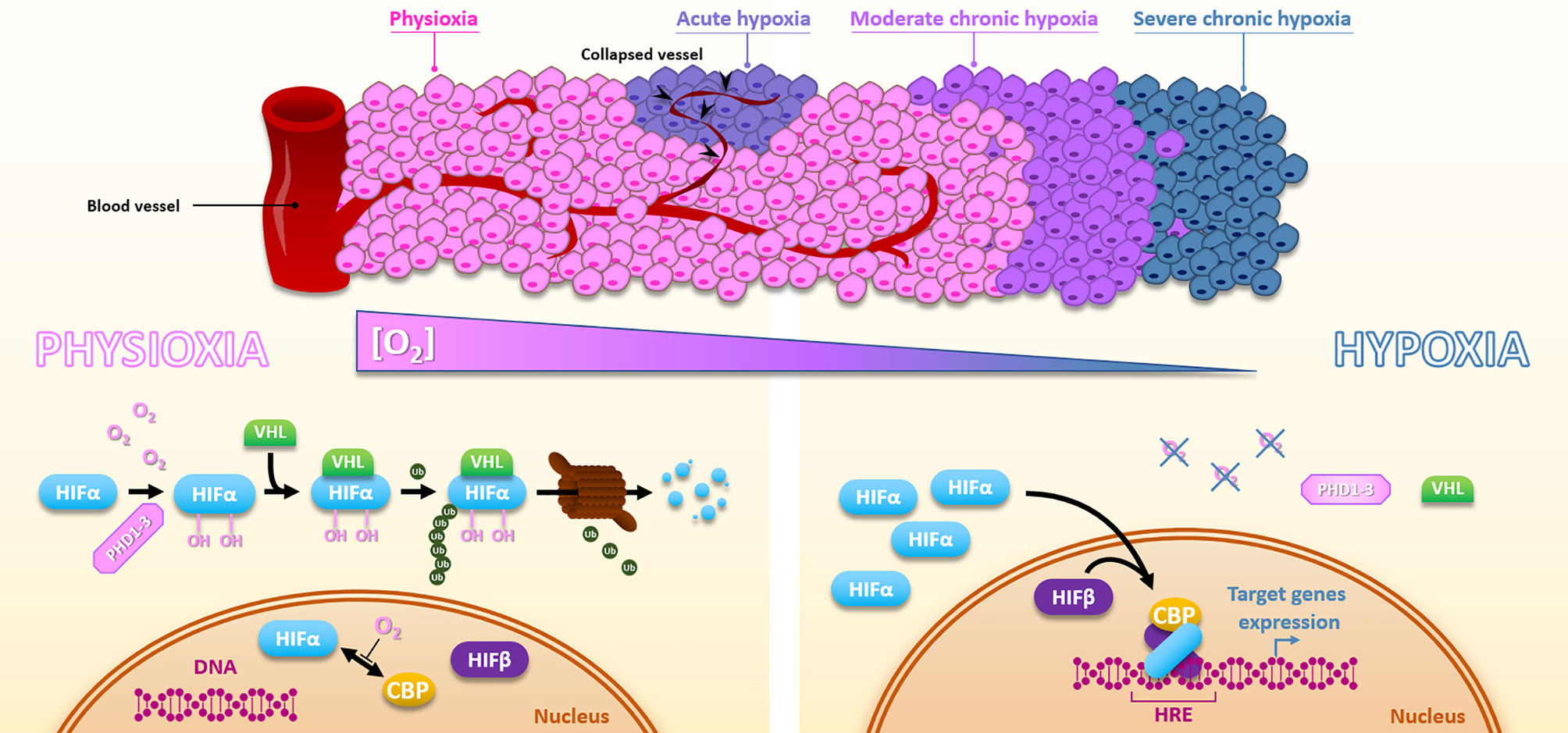
Гипоксия-активируемые пролекарства (HAP)
В 1980-х годах в нескольких исследованиях был предложен таргетинг гипоксии гипоксия-специфическими цитотоксинами, которые теперь известны как гипоксия-активируемые пролекарства (HAP) [1,2]. HAP представляют собой соединения, которые могут селективно редуцироваться эндогенными клеточными оксидоредуктазами с образованием цитотоксических агентов в гипоксических условиях. Этот биоредуктивный процесс в норме ингибируется молекулярным кислородом, который прямо конкурирует за один электрон изначально редуцированного пролекарства, препятствуя полной редукции соединения в его активную форму. Супероксидный продукт затем детоксицируется супероксиддисмутазой (SOD), результируя в низкую токсичность в нормальных тканях. Однако в гипоксических условиях пролекарство редуцируется, полностью высвобождая активное соединение, позволяя специфически таргетировать гипоксические регионы [3].
Начиная с 1960-х годов открытие прямой зависимости между электронной аффинностью сенсибилизирующего агента и степенью радиосенсибилизации привело к изучению нитроароматических соединений в качестве потенциальных модификаторов гипоксии [4]. Эти типы HAP обладают высоким сродством к электрону, что позволяет им фиксировать или стабилизировать радиация-индуцированные ДНК повреждения, делая их нерепарируемыми и, следовательно, летальными [5]. Химические свойства нитроароматических препаратов в гипоксии напоминают свойства кислорода, поэтому их часто называют «кислородными миметиками».

Фиг. 1. Общая схема редуктивной активации HAP одним или двумя электронами
Первыми нитроароматическими препаратами, тестированными как радиосенсибилизаторы, были метронидазол и мизонидазол. Эти нитроароматические молекулы показали высокую эффективность и in vitro, и в доклинических моделях [6,7]. Однако клинические исследования обоих соединений не увенчались успехом, показав отсутствие повышения выживаемости пациентов между комбинированным лечением с лучевой терапией и только лучевой терапией [8,9,10]. Это было связано с высокой токсичностью, которая была вызвана большим объемом распределения и более длительным периодом полувыведения препарата у человека по сравнению с мышиными моделями. В результате высокая токсичность этих соединений ограничивала максимально переносимую дозу, что приводило к низкой радиосенсибилизации. Для повышения эффективности лечения были разработаны и клинически испытаны три новых нитроароматических соединения с улучшенными фармакокинетическими свойствами и репродуцируемой токсичностью: этанидазол, пимонидазол и ниморазол. Хотя этанидазол был завершен в фазе II и фазе III клинических исследований, он не показал каких-либо улучшений ни у пациентов с HNSCC, ни у пациентов с мелкоклеточным раком легкого (SCLC) [11,12]. Пимонидазол также не смог подтвердить преимущества комбинированного лечения с лучевой терапией по сравнению только с лучевой терапией у пациентов с карциномой шейки матки [13]. Однако в настоящее время пимонидазол широко используется для измерения опухолевой гипоксии методом иммуногистохимического окрашивания [14].
В отличие от этанидазола и пимонидазола ниморазол показал многообещающие клинические результаты. Это улучшило радиотерапевтический эффект при надгортанных опухолях и опухолях глотки без побочных эффектов в датском исследовании рака головы и шеи (DAHANCA) [15]. В результате ниморазол в настоящее время стал стандартным средством лечения HNSCC в Дании, хотя по-прежнему необходима оценка, изменяет ли ниморазол непосредственно статус оксигенации опухолей пациентов. В недавнем клиническом исследовании фазы I/II для p16-негативного HNSCC сообщалось о положительных результатах комбинации ниморазола и лучевой терапии [16]. В дополнение к двум текущим клиническим исследованиям ниморазола в Дании (NCT02661152 и NCT02976051) в Великобритании проводится рандомизированное клиническое исследование пациентов с HNSCC, проходящих лучевую терапию, которым не подходит синхронная химиотерапия или цетуксимаб (NCT01950689).
Литература:
1. Corry P.M., Dewhirst M.W. Thermal medicine, heat shock proteins and cancer. Int. J. Hyperth. 2005;21:675–677. doi: 10.1080/02656730500272856
2. Park C.H., Lee M.J., Ahn J., Kim S., Kim H.H., Kim K.H., Eun H.C., Chung J.H. Heat shock-induced matrix metalloproteinase (MMP)-1 and MMP-3 are mediated through ERK and JNK activation and via an autocrine interleukin-6 loop. J. Investig. Dermatol. 2004;123:1012–1019. doi: 10.1111/j.0022-202X.2004.23487.x
3. Ware J.L., Paulson D.F., Mickey G.H., Webb K.S. Spontaneous metastasis of cells of the human prostate carcinoma cell line PC-3 in athymic nude mice. J. Urol. 1982;128:1064–1067. doi: 10.1016/S0022-5347(17)53345-5
4. Lee T.H., Bu J., Kim B.H., Poellmann M.J., Hong S., Hyun S.H. Sub-lethal hyperthermia promotes epithelial-to-mesenchymal-like transition of breast cancer cells: Implication of the synergy between hyperthermia and chemotherapy. RSC Adv. 2019;9:52–57. doi: 10.1039/C8RA08472F. [CrossRef] [Google Scholar]
5. Brown J.M., Koong A. Therapeutic advantage of hypoxic cells in tumors: A theoretical study. J. Natl. Cancer Inst. 1991;83:178–185. doi: 10.1093/jnci/83.3.178
6. Kennedy K.A. Hypoxic cells as specific drug targets for chemotherapy. Anticancer Drug Des. 1987;2:181–194
7. Guise C.P., Mowday A.M., Ashoorzadeh A., Yuan R., Lin W.H., Wu D.H., Smaill J.B., Patterson A.V., Ding K. Bioreductive prodrugs as cancer therapeutics: Targeting tumor hypoxia. Chin. J. Cancer. 2014;33:80–86. doi: 10.5732/cjc.012.10285
8. Adams G.E., Cooke M.S. Electron-affinic sensitization. I. A structural basis for chemical radiosensitizers in bacteria. Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 1969;15:457–471. doi: 10.1080/09553006914550741
9. Oronsky B.T., Knox S.J., Scicinski J. Six degrees of separation: The oxygen effect in the development of radiosensitizers. Transl. Oncol. 2011;4:189–198. doi: 10.1593/tlo.11166
10. Kappen L.S., Lee T.R., Yang C.C., Goldberg I.H.J.B. Oxygen transfer from the nitro group of a nitroaromatic radiosensitizer to a DNA sugar damage product. Biochemistry. 1989;28:4540–4542. doi: 10.1021/bi00437a004
11. Asquith J.C., Foster J.L., Willson R.L., Ings R., McFadzean J.A. Metronidazole (“Flagyl”). A radiosensitizer of hypoxic cells. Br. J. Radiol. 1974;47:474–481. doi: 10.1259/0007-1285-47-560-474
12. Dische S., Saunders M., Lee M.E., Adams G., Flockhart I.J.B.j.o.c. Clinical testing of the radiosensitizer Ro 07-0582: Experience with multiple doses. Br. J. Cancer. 1977;35:567–579. doi: 10.1038/bjc.1977.90
13. Urtasun R., Feldstein M., Partington J., Tanasichuk H., Miller J., Russell D., Agboola O., Mielke B.J.B.j.o.c. Radiation and nitroimidazoles in supratentorial high grade gliomas: A second clinical trial. Br. J. Cancer. 1982;46:101–108. doi: 10.1038/bjc.1982.171
14. Dische S.J.R. Chemical sensitizers for hypoxic cells: A decade of experience in clinical radiotherapy. Radiother. Oncol. 1985;3:97–115. doi: 10.1016/S0167-8140(85)80015-3
15. Eschwège F., Sancho-Garnier H., Chassagne D., Brisgand D., Guerra M., Philippe Malaise E., Bey P., Busutti L., Cionini L., N’Guyen T., et al. Results of a european randomized trial of Etanidazole combined with radiotherapy in head and neck carcinomas. Int. J. Radiat. Oncol. 1997;39:275–281. doi: 10.1016/S0360-3016(97)00327-1
16. Urtasun R.C., Palmer M., Kinney B., Belch A., Hewitt J., Hanson J. Intervention with the hypoxic tumor cell sensitizer etanidazole in the combined modality treatment of limited stage small-cell lung cancer. A one-institution study. Int. J. Radiat. Oncol. Biol. Phys. 1998;40:337–342. doi: 10.1016/S0360-3016(97)00771-2